Составление уравнений окислительно-восстановительных реакций
Знакомясь со свойствами галогенов, мы уже много раз встречались с реакциями окисления-восстановления. Эти реакции нередко выражаются довольно сложными уравнениями с большими коэффициентами при формулах веществ, участвующих в реакции. При составлении таких уравнений главное затруднение представляет правильный подбор коэффициентов. Существует несколько приемов нахождения коэффициентов, наиболее простым из них является прием, основанный на подсчете электронов, приобретаемых и отдаваемых вступающими в реакцию веществами.
Так как при реакциях окисления-восстановления электроны не берутся откуда-то со стороны, а только переходят от одних атомов или ионов к другим, то очевидно, что число электронов, приобретаемых окислителем, должно равняться числу электронов, отдаваемых восстановителем. Поэтому, составляя уравнение реакции между окисляющим и восстанавливающим веществами, коэффициенты при формулах этих веществ подбирают так, чтобы произведение из числа реагирующих атомов или молекул окисляющего вещества на число приобретаемых им электронов равнялось аналогичному произведению для восстанавливающего вещества.
Подсчет числа электронов, отдаваемых восстановителем и приобретаемых окислителем, нетрудно произвести, зная, как изменяется в результате реакции валентность атомов или ионов окислителя и восстановителя.
При составлении уравнений окислительно-восстановительных реакций необходимо, конечно, знать, во что превращаются окисляющие и восстанавливающие вещества в результате реакции. Нередко это можно заранее предсказать на основании известных свойств реагирующих веществ. Нужно также учитывать, что если реакция протекает в водном растворе, то в ней может принимать участие вода; вопрос об участии воды выясняется при составлении уравнения реакции.
Попробуем составить несколько уравнений окислительно-восстановительных реакций, чтобы на конкретных примерах ознакомиться с приемом нахождения коэффициентов.
1. Окисление, йодистого, водорода концентрированной серной кислотой. При действии конг центрированной серной кислоты на йодистый водород выделяется свободный иод, а серная кислота восстанавливается до сероводорода.
Схема этой реакции такова:
HJ + H2SО4 → J2 + H2S
Определяем валентность участвующих в окислении-восстановлении элементов до и после реакции и отмечаем ее римскими цифрами над символами элементов:
HJ + H2SO4 → J2 + H2S
Из схемы видно, что валентность иода повысилась с —1 до 0; следовательно, иод окислился и каждый ион его потерял в процессе реакции один электрон. Валентность же серы понизилась с +6 до —2, т. е. сера восстановилась. Понижение валентности серы произошло вследствие перехода электродов от иода к серной кислоте. Можно принять, что при этом каждый атом серы, ковалентно связанный с атомами кислорода в серной кислоте, присоединил восемь электронов и превратился в ион S—
Обозначив этот атом через S (+VI), записываем происходящее при реакции перемещение электронов в виде следующих электронных уравнений:
Так как число электронов, отдаваемых ионами иода, должно равняться числу электронов, присоединяемых атомами серы S(+VI) в молекулах серной кислоты, то очевидно, что на каждый атом серы надо взять восемь ионов иода, т. е. на одну молекулу H2SO4 восемь молекул HJ. Это и отмечено цифрами, стоящими слева от написанных уравнений. Таким образом, мы находим коэффициенты при окислителе и восстановителе, а вместе с тем и коэффициенты для веществ, получающихся в результате окисления-восстановления, так как совершенно ясно, что из восьми молекул HJ должны образоваться четыре молекулы J2 и из одной молекулы H2SO4 только одна молекула H2S. Подставляя найденные коэффициенты в схему реакции, получаем:
8HJ + H2SO4 → 4J2 + H2S
Сравнивая теперь число атомов водорода в обеих частях схемы, находим, что в правой части недостает восьми атомов водорода. Очевидно, что, помимо указанных в схеме непосредственных продуктов окисления-восстанозления, при реакции образуется еще вода. Число молекул воды устанавливаем, исходя из числа недостающих атомов водорода. Вводя в правую часть схемы четыре молекулы воды, получаем окончательное уравнение реакции:
8HJ + H2SO4 = 4J2 + H2S + 4H2O
Наконец, проверяем число атомов кислорода з обеих частях уравнения и убеждаемся, что уравнение составлено правильно.
2. Окисление меди разбавленной азотной кислотой. При взаимодействии меди с разбавленной азотной кислотой продуктами окисления-восстановления являются азотнокислая медь Сu(NO3)2 и окись азота:
Сu + HNO3 → Cu(NO3)2 + NO
Из схемы видно, что в результате реакции атом меди окисляется, теряя два электрона, а пятивалентный атом азота восстанавливается, присоединяя три электрона:
Следовательно, для окисления трех атомов меди требуются две молекулы азотной кислоты и в результате окисления-восстановления должны получиться три иона меди, входящие в состав Cu(NO3)2, и две молекулы NO:
3Cu + 2HN03 →3Cu(N03)2 + 2NO
Однако, сравнивая число атомов меди и азота в обеих частях схемы, мы видим, что справа на шесть атомов азота больше, чем слева. Чтобы уравнять число атомов азота, нужно в левой части схемы увеличить коэффициент при формуле азотной кислоты до восьми. Таким образом, всего в реакции будут участвовать восемь молекул азотной кислоты; но из них только две расходуются на окисление меди, так как только два атома азота понижают свою валентность с +5 до +2:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO
Проверяем теперь число атомов водорода. В левой части схемы восемь атомов водорода, тогда как в правой водород совсем отсутствует. Очевидно, при реакции образуются еще четыре молекулы воды. Указав их в правой части схемы, получаем окончательное уравнение реакции:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4Н20
Реакции, при которых окислитель или восстановитель, кроме выполнения своей основной функции, расходуется еще на связывание образующихся при реакции ионов, встречаются довольно часто. Во всех таких случаях подбор коэффициентов производится, как указано выше.
В ионной форме рассматриваемая реакция выразится уравнением:
3Cu + 8Н• + 2NO3‘= 3Сu•• + 2NO + 4Н2O
из которого особенно, ясно видно, что на окисление трех атомов меди расходуются только два иона NO3‘, т. е. две молекулы азотной кислоты, а не все восемь, указанные в молекулярном уравнении.
При проверке правильности составления ионных уравнений следует иметь в виду, что во всяком ионном уравнении не только общее число атомов каждого элемента в той и другой части уравнения должно быть одинаково но и алгебраическая сумма всех зарядов в левой части уравнения должна равняться алгебраической сумме зарядов в правой части уравнения. Так, например, в данном случае в правой части уравнения шесть положительных зарядов (+2•3), в левой — алгебраическая сумма зарядов тоже равна шести (+ 8 — 2).
На основании разбора приведенных примеров можно рекомендовать придерживаться следующего порядка составления уравнений окислительно-восстановительных реакций:
1. Составить схему реакции, указав в ней вступающие в реакцию вещества и продукты окисления-восстановления.
2. Определить валентность участвующих в реакции элементов до и после реакции и установить, какие атомы или ионы окисляются и какие восстанавливаются.
3. Составить электронные уравнения для процесса окисления и для процесса восстановления и найти наименьшие числа, на которые нужно умножить эти уравнения, чтобы число электронов в обоих уравнениях стало одинаковым.
Найденные числа являются коэффициентами при окислителе и восстановителе. Тем самым определяются коэффициенты для веществ, получающихся в результате окисления-восстановления. Коэффициенты для остальных веществ, если таковые участвуют в реакции, подбираются в последнюю очередь путем подсчета атомов (ионов) в обеих частях уравнения.
В заключение следует указать, что очень многие вещества проявляют окислительные или восстановительные свойства только в определенной среде — кислой или щелочной. Так, например, азотная кислота, или, точнее, ионNO3‘, является энергичным окислителем в кислой среде, но не проявляет окислительных свойств в нейтральной среде, когда мы берем его в виде какой-нибудь соли азотной кислоты; галогены (хлор, бром) наиболее сильно проявляют окислительные свойства в щелочной среде и т. д.
На практике для создания в растворе кислой среды обычно пользуются серной кислотой, а для создания щелочной среды — едким натром или едким кали.
Главные окислители: перманганат калия и двухромо-вокислый калий в сернокислом растворе, азотная кислота, галогены, бертолетова соль, гипохлорит натрия, перекись водорода.
Главные восстановители: неблагородные металлы и водород, уголь, кремний, окись углерода, соединения двухвалентного олова, сероводород, сернистая кислота, йодистый водород и др.
Вы читаете, статья на тему Составление уравнений реакций

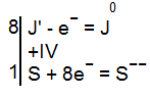
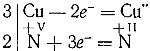
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.