ПОДГРУППА МЫШЬЯКА
Мышьяк (Arsenicum); ат. вес. 74,91. Мышьяк встречается в природе большей частью в соединениях с металлами или серой и лишь изредка в свободном состоянии. Содержание мышьяка в земной коре составляет 0,0005 весовых процента. Наиболее крупные запасы мышьяковых руд находятся в Швеции.
Обыкновенно мышьяк получают из мышьяковистого колчедана FeAsS. Эта руда при нагревании без доступа воздуха разлагается на сульфид железа и мышьяк, который благодаря своей летучести возгоняется. Получаемый продукт обычно загрязнен примесями, которые удаляют последующим рафинированием. Чистый мышьяк представляет собой темно-серое кристаллическое вещество с металлическим блеском, уд. вес. 5,73. Он очень хрупок, довольно хорошо проводит тепло и электрический ток; электропроводность его всего в 22 раза меньше, чем электропроводность меди.
Подобно фосфору, мышьяк образует несколько аллотропических видоизменений. Из них, кроме кристаллического мышьяка серого цвета, отметим еще черный аморфный мышьяк, который получается при разложении мышьяковистого водорода. Все аллотропические видоизменения мышьяка при нагревании возгоняются, не плавясь.
В воде мышьяк не растворим. На воздухе при обыкновенной температуре он окисляется очень медленно, при накаливании же сгорает, образуя белый мышьяковистый ангидрид As2О3 и распространяя характерный чесночный запах. При высокой температуре мышьяк непосредственно соединяется со многими элементами.
В своих соединениях мышьяк трех- и пятивалентен.
Как свободный мышьяк, так и все его соединения ядовиты.
Мышьяковистый водород AsH3
Или арсин, представляет собой бесцветный, очень ядовитый газ с характерным чесночным запахом, мало растворимый в воде. Мышьяковистый водород образуется при восстановлении всех мышьяковистых соединений водородом в момент выделения. Например:
As2О3 + 6Zn + 6H2SО4 = 2AsH3 + 6ZnSО4 +3H2О
Мышьяковистый водород довольно неустойчив и при нагревании легко разлагается на водород и свободный мышьяк.
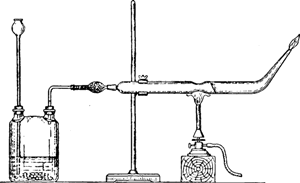
Способностью мышьяковистого водорода разлагаться при нагревании пользуются для открытия мышьяка в различных веществах. Для этой цели служит прибор, изображенный на рис 102. Он состоит из двугорлой склянки для получения водорода и тугоплавкой трубки с оттянутым и загнутым кверху концом и с перетяжкой посредине. Между склянкой и трубкой включается еще трубочка с хлористым кальцием для осушения выделяющегося водорода.
Поместив в склянку несколько кусочков чистого цинка, наливают в нее разбавленной серной кислоты и, когда весь воздух из прибора будет вытеснен, зажигают водород у оттянутого конца трубки. Затем прибавляют в склянку через воронку немного исследуемого вещества и нагревают трубку в суженном месте. Если вещество содержит мышьяк, то в склянке образуется мышьяковистый водород, который, проходя через нагретую часть трубки, разлагается. Выделяющийся при этом мышьяк отлагается на холодных частях трубки в виде блестящего черного налета («мышьяковое зеркало»).
Таким путем можно открыть ничтожные количества мышьяка.
С кислородом мышьяк образует два окисла: мышьяковистый ангидрид As2О3 и мышьяковый ангидрид As2О5.
Мышьяковистый ангидрид As2О3
Образуется при сгорании мышьяка на воздухе или при прокаливании мышьяковистых руд. Это белое кристаллическое вещество, называемое обыкновенно белым м ы ш ь я к о м. Мышьяковистый ангидрид довольно плохо растворяется в воде: насыщенный при 15° раствор содержит всего 1,5% As2О3. При растворении происходит присоедине-
няе воды к мышьяковистому ангидриду и образуется гидроокись мышьяка As(ОН)3 или H3AsО3:
As2О3 + 3Н2О = 2As(OH)3
Гидроокись мышьяка амфотерна, но у нее преобладают кислотные свойства, поэтому она называется мышьяковистой кислотой.
Мышьяковистая кислота H3AsО3
В свободном состоянии не получена и известна лишь в водном растворе. Она принадлежит к числу очень слабых кислот (К = 6 • 10-10). Соли ее называются арсенитами. Арсениты щелочных металлов легко могут быть получены действием щелочей на As2О3:
As2О3 + 6КОН = 2K3AsО3 + 3H2О
Многие арсениты являются производными метамышьяковистой кислоты HAsО2.
Мышьяковистая кислота и ее соли — энергичные восстановители.
При окислении!мышьяка или мышьяковистого ангидрида азотной кислотой получается мышьяковая кислота:
3As2О3 + 4HNО3 + 7Н2О = 6H3AsО4 + 4NO
Мышьяковая кислота H3AsО4
Твердое вещество, легко растворимое в воде. По силе она почти равна фосфорной. Соли ее — арсенаты — очень похожи на соответствующие фосфаты. Известны также мета- и пиромышьяковые кислоты. При прокаливании мышьяковой кислоты получается мышьяковый ангидрид As2О5 в виде белой стекловидной массы.
Сопоставление свойств мышьяковистой и мышьяковой кислот показывает, что у последней кислотные свойства выражены значительно сильнее, чем у первой. В этом изменении свойств проявляется общая закономерность, характерная для всех элементов: с повышением валентности элемента изменяется , характер его гидроокиси, кислотные свойства усиливаются, а основные — ослабевают.
Сульфиды мышьяка. Если пропускать сероводород в подкисленный соляной кислотой раствор H3ASO3, то образуется желтый осадок трехсернистого мышьяка As2S3, не растворимый в соляной кислоте. Происходящие реакции могут быть выражены уравнениями:
H3AsO3 + 3НСl ⇄ AsCl3 + 3H2O 2AsCl3+ 3H2S = ↓ As2S3 + 6HCl
Аналогичным путем можно получить желтый пятисернистый мышьяк As2S5, действуя сероводородом на раствор H3AsO4в соляной кислоте:
H3AsO4 + 5НСl ⇄ AsCl5 + 4Н2O
2AsCl5 + 5H2S = As2S5 + 10HCl
При взаимодействии с сульфидами щелочных металлов, Na2S, K2S и с (NH4)2S сульфиды мышьяка образуют растворимые в воде соли тиомышьяковистой H3AsS3 и тиомышьяковой H3AsS4 кислот, отличающихся от кислородных кислот мышьяка тем, что в них весь кислород замещен серой:
As2S3 + 3Na2S = 2Na3AsS3 тиоарсенит натрия
As2S5 + 3Na2S = 2Na3AsS4 тиоарсенат натрий
Соли тиомышьяковой кислоты получаются также при действии полисульфидов щелочных металлов на As2S3:
As2S3 + Na2S3 + 2Na2S = 2Na3AsS4
Свободные тиокислоты очень неустойчивы и легко разлагаются на сероводород и соответствующий сульфид. Например:
2H3AsS4 = As2S5 + 3H2S
Поэтому при действии сильных кислот на тиосоли мышьяка выделяется сероводород и образуются сульфиды мышьяка:
2Na3AsS3 + 6НСl = 6NaCl + As2S3 + 3H2S
2Na3AsS4 + 6HCl = 6NaCl + As2S5 + 3H2S
Разложение тиокислот на сероводород и сульфиды аналогично разложению соответствующих кислородных кислот на воду и ангидрид:
2H3AsO4 = As2O5+ 3H2O
2H3AsS4 = As2S5 + 3H2S
На этом основании сульфиды, образующие тиокислоты, называются тиоангидридами кислот.
Применение свободного мышьяка очень ограничено. Он прибавляется в небольшом количестве в различные сплавы цветных металлов для придания им твердости и коррозионной стойкости. Но соединения мышьяка имеют обширное применение, основанное на сильном физиологическом действии мышьяка почти на все растительные и животные организмы.
В медицине соединения мышьяка издавна применяются как лекарства, так как малые дозы мышьяка вызывают усиленный обмен веществ и действуют укрепляющим образом на организм. Обычно для этой цели употребляют разбавленные растворы арсенита калия. Мышьяк входит также в состав многих органических лечебных препаратов: новарсенол, сальварсан и др.
Другая обширная область применения соединений мышьяка — это сельское хозяйство, где многие соли мышьяковистой и мышьяковой кислот используются в качестве так называемых «инсектисидов», т. е. средств для уничтожения вредных насекомых.
Мышьяковистый ангидрид применяется в качестве яда для уничтожения крыс, мышей и других грызунов.
Сульфиды мышьяка применяются в качестве желтой краски, а также в кожевенной промышленности для удаления волос со шкур.
Добыча белого мышьяка As2O3 в капиталистических странах составляет в настоящее время 60—70 тыс. т и сосредоточена главным образом в США и в Швеции.
Вы читаете, статья на тему Подгруппа мышьяка

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.