Атомный радиус — это расстояние от атомного ядра до самого внешнего стабильного электрона нейтрального атома.
На практике величина получается путем измерения диаметра атома и деления его пополам.
Радиусы нейтральных атомов колеблются от 30 до 300 пм или триллионных долей метра.
А ионный радиус равен половине расстояния между двумя атомами газа, которые только что соприкоснулись друг с другом.
Рис. Соприкасающиеся частицы в кристалле.
Как определить радиус атомов и ионов
Применение рентгеновых лучей к исследованию кристаллов дает возможность не только устанавливать внутреннее строение последних, но и определять размеры частиц, образующих кристалл, — атомов или ионов.
Чтобы понять, как производятся такие вычисления, представим себе, что частицы, из которых построен кристалл, имеют сферическую форму и соприкасаются друг с другом.
В таком случае мы можем считать, что расстояние между центрами двух соседних частиц равно сумме их радиусов (рис.).
Если частицами являются атомы простого вещества и расстояние между ними измерено, то тем самым определяется и радиус атома, очевидно, равный половине найденного расстояния.
Например, зная, что для кристаллов металлического натрия константа решетки d равна 3,84 ангстрема, находим, что радиус r атома натрия равен.
Несколько сложнее производится определение радиусов различных ионов.
Здесь уже нельзя просто делить расстояние между ионами пополам, так как размеры ионов неодинаковы.
Но если радиус одного из ионов r1 известен, то радиус другого r2 легко находится простым вычитанием:
r2 = d — r1
Отсюда следует, что для вычисления радиусов различных ионов по константам кристаллических решеток нужно знать радиус хотя бы какого-нибудь одного иона.
Тогда нахождение радиусов всех остальных ионов уже не представит затруднений.
Как определяют радиусы атомов и ионов
При помощи оптических методов удалось довольно точно определить радиусы ионов фтора F— (1,33 А) и кислорода O—(1,32 А).
Эти радиусы и служат исходными величинами при вычислении радиусов других ионов.
Например, определение константы решетки окиси магния MgO показало, что она равна 2,1 ангстрема.
Вычитая отсюда величину радиуса иона кислорода, находим радиус иона магния:
2,1 — 1,32 = 0,78 Å
Константа решетки фтористого натрия равняется 2,31 Å; так как радиус иона фтора 1,33 ангстрема, то радиус иона натрия должен равняться:
2,31 —1,33 = 0,98 Å
Зная радиус иона натрия и константу решетки хлористого натрия, легко рассчитать радиус иона хлора и т. д.
Таким путем определены радиусы почти всех атомов и ионов.
Общее представление о размерах этих величин дают данные, приведенные в таблице.
Таблица радиусы атомов и ионов некоторых элементов
| Элемент | Радиус атома | Радиус иона | Символ иона |
| Натрий | 1,92 | 0,98 | Na+ |
| Калий | 2,38 | 1,33 | К+ |
| Рубидий | 2,51 | 1,49 | Rb+ |
| Цезий | 2,70 | 1,65 | Cs+ |
| Магний | 1,60 | 0,78 | Mg++ |
| Кальций | 1,97 | 1,06 | Са++ |
| Барий | 2,24 | 1,43 | Ва++ |
| Фтор | 0,67 | 1,33 | F— |
| Хлор | 1,07 | 1,81 | Сl— |
| Бром | 1,19 | 1,96 | Вr— |
| Йод | 1,36 | 2,20 | J— |
| Сера | 1,04 | 1,74 | S— |
Как показывают эти данные, у металлов радиусы атомов больше, чем радиусы ионов, у металлоидов, наоборот, радиусы ионов больше, чем радиусы атомов.
Относительные размеры ионов
Относительные размеры ионов, образующих кристалл, оказывают огромное влияние на структуру пространственной решетки.
Например, два очень сходных по своей химической природе вещества — CsCl и NaCl тем не менее образуют решетки различного типа.
Причем в первом случае каждый положительный ион окружен восьмью отрицательными ионами, а во втором — только шестью.
Это различие объясняется тем, что размеры ионов цезия и натрия неодинаковы.
Ряд соображений заставляет принять, что ионы должны располагаться в кристалле так, чтобы каждый меньший ион по возможности целиком заполнял пространство между окружающими его большими ионами и наоборот.
Другими словами, отрицательные ионы, которые почти всегда больше положительных, должны возможно теснее окружать положительные ионы, иначе система будет неустойчивой.
Так как радиус иона Cs+ равен 1,65 Å, а иона Na+ только 0,98 Å, то очевидно, что вокруг первого может разместиться больше ионов Сl—, чем вокруг второго.
Координационное число
Число отрицательных ионов, окружающих каждый положительный ион в кристалле, называется координационным числом данной решетки.
Изучение структуры различных кристаллов показывает, что наиболее часто встречаются следующие координационные числа: 2, 3, 4, 6, 8 и 12.
Координационное число зависит от отношения радиуса положительного иона к радиусу отрицательного иона: чем ближе это отношение к единице, тем больше координационное число.
Рассматривая ионы как шары, расположенные в кристалле по способу наиболее плотной упаковки.
Можно рассчитать, при каком соотношении между радиусом положительного и отрицательного ионов должно получиться то или иное координационное число.
Определение координационного числа
Ниже приведены вычисленные теоретически наибольшие координационные числа для данного отношения радиусов.
Нетрудно убедиться, что координационные числа для NaCl и CsCl, найденные по этой таблице, как раз отвечают действительному расположению ионов в кристаллах указанных веществ.
Например, в случае NаСl отношение радиуса иона натрия (0,98 Å) к радиусу иона хлора (1,81 Å) равно 0,98:1,81 = 0,54.
Это отношение лежит в пределах 0,41—0,73; следовательно, в решетке NaCl координационное число должно равняться шести.
Например, ион алюминия +3 образуется при потере трех электронов, а ион серы —2 при присоединении двух электронов.
Заряд ионов обозначается теми же символами, что и атомы, с добавлением знаков плюс или минус.


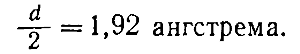
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.