Кинетическая теория газов
Одним из наиболее замечательных свойств газов является их легкая сжимаемость. Всякий газ может быть сжат в очень сильно, ударяются о стенки цилиндра и о поршень. Положим, что в секунду поршень получает 500 ударов.
Если мы вдвинем поршень до половины цилиндра, то тем самым мы уменьшим вдвое пространство, занимаемое молекулами. Теперь в единице объема будет вдвое больше молекул; поэтому поршень получит в секунду не 500, а 1000 ударов; следовательно, давление увеличится вдвое.
Если бы мы уменьшили объем в три раза, то, рассуждая так же, пришли бы к заключению, что давление должно увеличиться втрое, и т. д. Таким образом, становится понятным экспериментально найденный закон Бойля—Мариотта, согласно которому давление данной массы газа при неизменной температуре обратно пропорционально занимаемому газом объему.
Рис. Прибор для демонстрации различия скорости движения молекул разных газов
При нагревании газа скорость движения молекул увеличивается, а следовательно, увеличивается и их кинетическая энергия, равная половине произведения массы на квадрат скорости. Поэтому сила ударов молекул о стенки сосуда становится больше и давление газа возрастает.
Один из основных выводов кинетической теории гласит, что
молекулы всех газов при одной и той же температуре обладают одинаковой средней кинетической энергией.
Это значит, что с изменением массы молекулы скорость ее изменяется так, что произведение массы на квадрат скорости остается постоянным. Поэтому давление газа при данной температуре, обусловленное ударами его молекул, зависит только от числа молекул в единице объема газа, но не зависит от массы молекул, т. е. от природы газа.
Если обозначить массы молекул двух газов через т1 и т2 а средние скорости их соответственно через υ1 и υ2 то на основании предыдущего можно написать:
откуда
т. е. средние скорости молекул обратно пропорциональны корням квадратным из их молекулярных весов.
Кинетическая теория позволяет вычислить среднюю скорость движения молекул. Эта скорость оказывается очень большой и различной для разных газов. Так, при 0° молекула водорода движется в среднем со скоростью 1695 м/сек, молекула кислорода со скоростью 430 м/сек и т. д.
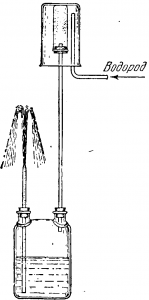
В неодинаковой скорости движения молекул различных газов можно убедиться, проделав следующий опыт. Возьмем пористый глиняный цилиндр и плотно закроем его пробкой, через которую проходит стеклянная трубка, соединяющая цилиндр с двугорлой склянкой (рис.).
В другое горлышко склянки вставим стеклянную трубку, доходящую до дна склянки, и нальем в склянку воды. Если на пористый цилиндр надвинуть стакан, предварительно наполненный водородом, то немедленно же начнется диффузия водорода в воздух и воздуха в водород.
Но молекулы водорода, благодаря большей скорости движения, быстрее проникают внутрь цилиндра, чем оттуда уходят более тяжелые молекулы кислорода и азота. В результате давление внутри цилиндра и двугорлой склянки повышается и вода начинает бить из склянки фонтаном (см. рис.).

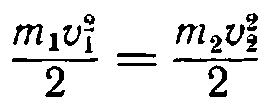
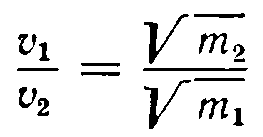
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.