Основные представления кинетической теории газов
Так, количество частиц, имеющих определенные скорости, при неизменных внешних условиях, и в частности при неизменной температуре Т газа, остается постоянным, хотя состав этих молекул непрерывно меняется. При этом большая часть молекул имеет скорости, мало отличающиеся от некоторой величины, называемой наиболее-вероятной скоростью и характерной для данных внешних условий.
Кто открыл закон закон распределения молекул
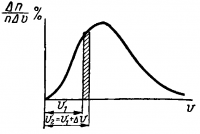
Общий закон распределения молекул по скоростям для идеального газа был установлен Максвеллом. Обычно этот закон выражают графиком, по которому можно найти относительное число молекул ∆n/n, скорости которых лежат в заданном интервале скорости ∆υ. На графике (рис. 2) по вертикальной оси отложены величины ∆n/n∆υ, по горизонтальной скорости υ. Искомое число молекул ∆n/n находится как площадь, ограниченная кривой графика и ординатами, соответствующими скоростям υ2 и υ1 определяющими заданный интервал:
∆υ=υ2 — υ1
Пример определения
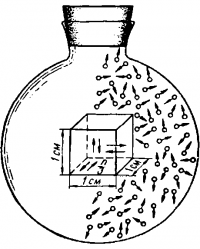
Выделим в газе сосуд в виде куба с ребром а=1 см (рис.) и допустим, что в нем содержится N молекул. Примем в первом приближении, что молекулы ударяются о стенку сосуда перпендикулярно и что о каждую стенку в среднем ударяется одинаковое число молекул. Тогда по каждому из трех взаимно перпендикулярных направлений в кубе (на рис показаны стрелками) будут двигаться одновременно в среднем N/3 молекул.
Если средняя скорость молекулы υср, то расстояние а = 1см между противоположными гранями куба молекула пройдет за время 1/υср и о каждую из граней куба ударится υср/2 раз в секунду. При каждом ударе она передаст грани куба импульс i=2mυср , тогда импульс 1, испытываемый каждой гранью за 1 сек, будет:
I = 2mυср(υср/2)(N/3) = Nmυ2ср/3
где m — есть масса одной молекулы.
Если в определенном объеме V имеется смесь газов, которые химически между собой не взаимодействуют, и если средняя кинетическая энергия молекул не зависит от природы газа и, следовательно, при одинаковой температуре для всех газов одинакова, то давление смеси газов зависит только от общего числа молекул в единице объема газа независимо от их природы. Если N1 молекул одного газа создает давление p1 а N2 молекул другого газа — давление р2, то сумма (N1 + N2) молекул в смеси газа создает суммарное давление
p = p1 + p2.
Это есть закон Дальтона, которым установлено, что давление смеси идеальных газов равно сумме давлений каждого газа в отдельности. Давление, которое имел бы отдельно каждый газ, входящий в состав смеси, если бы он занимал такой же объем, называется парциальным давлением. Поэтому закону Дальтона может быть дана также такая формулировка: давление смеси газов равняется сумме их парциальных давлений.
Статья на тему Кинетическая теория газов

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.