Молекулярно кинетическая теория МКТ это теория которая рассматривает свойства вещества, которые обусловлены его молекулярным строением: превращения вещества при изменении энергии его молекул, изменения агрегатных состояний тел и т. п.
Что такое молекулярно кинетическая теория
Основные положения молекулярно кинетической теории и ее опытные обоснования
Основные положения молекулярно кинетической теории сводятся к следующим:
- Все тела состоят из мельчайших частиц —атомов и молекул;
- Молекулы всегда находятся в непрерывном беспорядочном движении;
- Молекулы различных веществ по-разному взаимодействуют друг с другом. Их взаимодействие существенно зависит от типа молекул и расстояния между ними.
О правильности атомно-молекулярного строения вещества свидетельствуют такие явления.
- Беспорядочное движение мельчайших твердых частиц, взвешенных в жидкости или газе — броуновское движение, объясняемое ударами, которые испытывает броуновская частица со стороны молекул жидкости или газа.
- Давление газа на стенки сосуда, объясняемое ударами молекул газа о стенки.
- Закон кратных отношений Дальтона в химии: массы реагирующих между собой элементов не произвольны, а находятся в некоторых постоянных (кратных) отношениях.
- Закон Авогадро: в равных объемах при одинаковой температуре и давлении все газы содержат одинаковое число молекул. Грамм-молекула газа (моль), то есть масса газа в граммах, численно равная его молекулярному весу, при нормальных условиях занимает объем 22,41 литра.
- Диффузия, внутреннее трение в жидкости или газе и теплопроводность.
- Фотографирование отдельных крупных молекул при помощи электронного микроскопа и электронного микропроектора.
Броуновское движение
Броуновское движение весьма наглядно подтверждает наличие непрерывного хаотического движения молекул вещества.
Наблюдая в сильный микроскоп за маленькими частицами, находящимися в спокойной жидкости или газе (например, за капельками жира в воде), можно увидеть движение этих частиц.
Оно непрерывно и беспорядочно. Чем меньше частица, тем интенсивнее она движется. Это явление, открытое английским ботаником Броуном в 1827 г., получило название броуновского движения.
Движение частиц
Было доказано, что движение частиц вызвано толчками окружающих молекул жидкости или газа. Хотя молекулы жидкости (газа) ударяют частицы со всех сторон, но иногда с одной стороны о частицу ударится больше молекул, чем с другой, в результате чего частица начинает двигаться.
Броуновские частицы под влиянием беспорядочных ударов молекул и совершают движение.
На интенсивность броуновского движения влияет температура: с ее повышением увеличивается скорость движения молекул вещества.
Диффузия в газах, жидкостях, твердых телах
Диффузией называется процесс проникновения молекул одного вещества в межмолекулярное пространство другого вещества при их соприкосновении.
Если в стеклянный стакан бросить вату, смоченную бромом, и закрыть крышкой, то видно как пары брома бурого цвета расходятся по всему стакану.
Диффузию жидкостей можно наблюдать на следующем опыте. Нальем в стеклянный сосуд раствор медного купороса, а сверху чистую воду так, чтобы была видна резкая граница между ними.
Плотность чистой воды меньше, чем плотность раствора медного купороса, поэтому под действием силы тяжести резкость границы не должна нарушиться.
Через несколько дней резкая граница между жидкостями исчезнет, так как происходит взаимная диффузия медного купороса и воды.
Диффузия твердых тел
Чтобы наблюдать диффузию в твердых телах, необходимо сблизить поверхности двух тел (пришлифовать).
Когда расстояние между поверхностями двух тел станет равным расстоянию между частицами внутри самих тел (10-8 см), начнут действовать молекулярные силы сцепления, что приведет к сращиванию их в одно тело.
Молекулы твердого тела только колеблются около положений равновесия. Однако среди молекул, расположенных в поверхностном слое одного тела, могут оказаться молекулы с большой амплитудой колебания.
Которые во время колебаний настолько удаляются от молекул кристалла одного тела, что попадают в сферу притяжения молекул кристалла другого тела и захватываются им.
На новом месте молекулы продолжают совершать колебательные движения.
Диффузия быстрее происходит в газах, а медленнее — в твердых телах. Она резко возрастает с повышением температуры.
Взаимодействие молекул
Способность твердого тела сопротивляться растяжению, существование сил поверхностного натяжения жидкостей являются доказательствами наличия сил взаимного притяжения между молекулами вещества в любом агрегатном состоянии.
О том, что между молекулами действуют также и силы взаимного отталкивания, говорят следующие факты: способность жидких, твердых тел и уплотненных газов сопротивляться сжатию.
Если бы не было сил притяжения и отталкивания, которые действуют одновременно, то частицы, образующие тела, разлетелись бы в разные стороны или «слиплись» бы.
Силы взаимного притяжения и отталкивания по-разному зависят от расстояний между молекулами: на очень близких расстояниях преобладают силы отталкивания, а на более далеких — силы взаимного притяжения. На бесконечно большом удалении друг от друга молекулы не взаимодействуют.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие имеет электрическую природу, хотя молекула в целом электрически нейтральна, так как суммы положительных и отрицательных зарядов в ней равны друг другу.
При такой компенсации электрических зарядов электрическое поле за пределами молекулы быстро убывает с расстоянием.
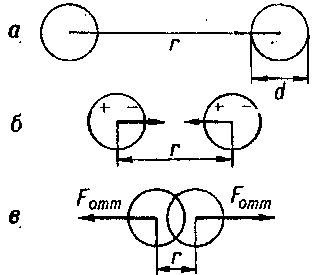
Уже на расстоянии двух-трех диаметров молекулы можно считать поле равным нулю. Поэтому на расстоянии между центрами двух молекул г, превышающем несколько диаметров молекулы, силы взаимодействия между молекулами слишком малы (рис. 2, а).
Если сблизить эти молекулы на расстояние двух-трех диаметров, возникает взаимодействие электрических зарядов ядер и электронных оболочек молекул. Разноименные заряды начнут притягиваться, а одноименные отталкиваться.
Это приведет к небольшой деформации взаимодействующих молекул (на рис. 2, б показано мгновенное распределение зарядов в молекулах). Между молекулами возникают силы притяжения Fприт.
Эти силы возникают вследствие того, что расстояние между разноименными зарядами чуть меньше, чем между одноименными.
При дальнейшем сближении молекул будет возрастать их деформация и возрастать величина сил притяжения.
Но, когда молекулы «соприкоснутся» своими электронными оболочками, дальнейшее их сближение станет невозможным, так как между электронными оболочками этих молекул возникнут большие силы отталкивания (рис. 2, в).
Силы отталкивания резко возрастают при уменьшении расстояния между центрами молекул.
Ha некотором, определенном для данной пары молекул, взаимном расстоянии r0 силы притяжения и силы отталкивания уравновесят друг друга, а результирующая сила F (r0) станет равна нулю.
Такое расстояние r0 соответствует положению равновесия взаимодействующих молекул, если отсутствует тепловое движение.
Изучая поведение большой совокупности молекул, удобно пользоваться не силой взаимодействия молекул, а потенциальной энергией U.
B положении равновесия, когда r = r0, система молекул обладает наименьшим запасом потенциальной энергии Uмин.
При хаотическом тепловом движении молекул средняя кинетическая энергия имеет порядок kT, где k —постоянная Больцмана, равная 1,38• 10-23 Дж/град, а Т—абсолютная температура. Агрегатное состояние вещества существенно зависит от соотношения между Uмин и kT.
При низких температурах, когда кинетическая энергия молекул мала (kT << | Uмин|), молекулы притянутся друг к другу вплотную и установятся в определенном порядке — вещество находится в твердом агрегатном состоянии.
При высоких температурах, то есть при большой кинетической энергии молекул (kT >> | Uмин |), интенсивное тепловое движение молекул мешает молекулам соединиться в агрегаты из нескольких частиц, оставляя их на некотором расстоянии r < r0 друг от друга. Вещество при этом находится в газообразном агрегатном состоянии.
Если взять промежуточные значения температур (kT≈ | Uмин |), то оказывается, что молекулы непрерывно перемещаются в пространстве, обмениваясь местами.
Однако они не будут увеличивать взаимного расстояния на величину, заметно превышающую r0. Вещество при этом находится в жидком агрегатном состоянии.
Следовательно, в зависимости от температуры любое вещество может находиться в твердом, жидком или газообразном состоянии.
На агрегатные состояния вещества также влияет и объем, который занимает система его молекул. При достаточно больших объемах молекулы могут удаляться друг от друга на такие расстояния, на которых средняя энергия сил притяжения очень мала.
Поэтому всегда над твердыми и жидкими телами имеется небольшое количество того же вещества в газообразном состоянии.
Движение молекул газа, жидкостей и твердых тел
Среднее расстояние между молекулами газа в десятки раз превышает размеры его молекул. Только 0,04% объема, занятого газом, приходится на долю самих молекул, а остальная часть пространства составляет свободный от молекул объем.
Взаимного притяжения молекул газа практически нет, и их движение происходит по инерции. Молекула газа движется равномерно и прямолинейно до тех пор, пока не столкнется с другой молекулой, а, изменив направление и величину скорости, снова будет двигаться равномерно и прямолинейно до очередного столкновения.
Если молекулы газа состоят из нескольких атомов, то при столкновении они приобретают еще и вращательное движение. Таким образом, тепловое движение молекул газов является поступательным и вращательным.
В жидкостях силы сцепления молекул некоторое время удерживают их в равновесии, где они колеблются, а затем перескакивают в новое положение равновесия и т. д.
Таким образом, тепловое движение молекул жидкостей в основном является колебательным и поступательным.
В твердых телах молекулы расположены плотнее, чем в жидкостях, получаемых после плавления этих тел. Тепловое движение молекул в твердых телах в основном является колебательным, хотя возможны переходы молекул из одного положения в другое в твердых телах, что подтверждается диффузией.
Молекулярно кинетическая теория задачи
Пример решения задач 1.
Вычислить массу одной молекулы азота.
Решение.
Известно, что масса килограмм-молекулы азота (кмоля) μ = 28 (кг/кмоль) , а в одной килограмм-молекуле содержится N = 6,02 • 1026(1/кмоль) молекул (число Авогадро N = 6,02 • 1026(1/кмоль).
Тогда масса одной молекулы m = μ/N, m = (28(кг/кмоль))/(6,02 • 1026(1/кмоль)) = 4,65 • 10-26 кг.
Ответ: масса одной молекулы азота 4,65 • 10-26 кг
Задача 2
Сколько молекул содержится в 5 см3 газа при нормальных условиях?
Решение.
При нормальных условиях (Т0 = 273° К и р0 = 1,01 • 105 Па) киломоль любого газа занимает один и тот же объем V0 = 22,4(м3/кмоль). А в одном кмоле содержится N = 6,02 • 1026 молекул. Значит, число молекул в 5 см3 = 5 • 10-6 м3 газа:
n = (N/V0)V, n = (6,02 • 1026(1/кмоль))/(22,4(м3/кмоль)) • 5 • 10-6 = 13,5 • 1019.
Ответ: При нормальных условиях 13,5 • 1019молекул газа.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.