Закон эквивалентов
[no_toc]
В химии эквивалент это значит равноценное количество, а именно в таких количествах элементы не только соединяются между собой, но и замещают друг друга в соединениях.
Изучение весовых отношений, в которых различные элементы соединяются друг с другом, привело к открытию еще одной очень важной закономерности. Чтобы показать эту закономерность, обратимся к конкретным данным. Возьмем ряд соединений водорода, процентный состав которых приведен в табл. 1.
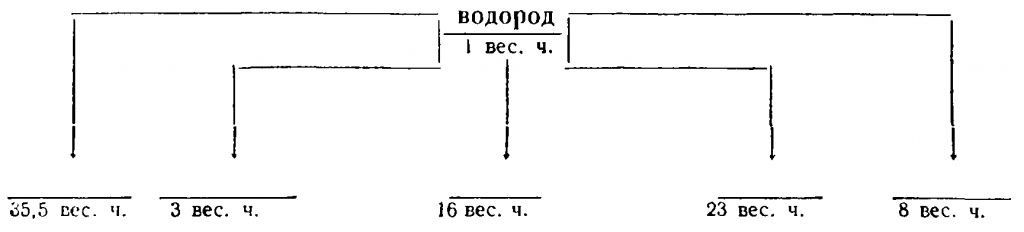
Рассчитаем, какие весовые количества других элементов приходятся в этих соединениях на одно и то же весовое количество водорода (например, на 1 вес. ч.). Результаты подсчета представлены в виде схемы рис. 2.
| Соединение | Состав в % | ||||
| хлор | углерод сера | натрий | кислород | водород | |
| Хлористый водород | 97,26 | 75 — нет | 95,83 | 88,89 |
2,74
|
Указанные в схеме элементы соединяются не только с водородом, но и друг с другом, причем их соединение происходит в тех же весовых количествах, в каких они соединяются с одной весовой частью водорода (табл. 2).
| Соединение | Состав в вес. частях | ||||
|
Четыреххлористый углерод
Окись натрия
Углекислый газ
|
хлор | сера | кислород | натрий углерод | |
|
35,5
35,5
35,5
|
16
16
|
8
8
8
|
23
23
|
3
3
3
|
|
К такому же выводу можно притти, взяв в качестве исходного элемента не водород, а какой-нибудь другой элемент, например кислород, хлор и т. д.
Таким образом, для всех элементов можно найти числа, выражающие весовые количества, в которых элементы соединяются друг с другом. Вначале эти числа получили название «соединительных весов».
Дальтон одним из первых вычислил соединительные веса многих элементов. При этом он поступал так же, как это было показано выше, т. е. принимал соединительный вес водорода за единицу. Но так как водород образует соединения далеко не со всеми элементами.
То вскоре стали вычислять соединительные веса по отношению к кислороду, условившись считать соединительный вес самого кислорода равным восьми. При этом условии соединительные веса, вычисленные по водороду, сохранили свою прежнюю величину, соединительный же вес самого водорода стал равным 1,008.
Впоследствии название «соединительный вес» было заменено названием «эквивалент», что значит — равноценное количество. В таких количествах элементы не только соединяются между собой, но и замещают друг друга в соединениях.
Эквивалент элемента
В настоящее время эквивалентом элемента называется весовое количество его, соединяющееся с восьмью весовыми частями кислорода или с 1,008 весовыми частями водорода или замещающее их в соединениях.
Введение понятия эквивалент позволило сформулировать следующий закон, называемый законом эквивалентов:
Элементы соединяются друг с другом в весовых количествах, пропорциональных их эквивалентам.
Эквиваленты обычно находят или по данным анализа различных соединений, или на основании результатов замещения одного элемента другим. Следует подчеркнуть, что для определения эквивалентов совершенно необязательно исходить из соединений с кислородом или водородом. Пользуясь законом эквивалентов, можно вычислить эквивалент по составу соединения данного элемента с любым другим, эквивалент которого известен.
Пример подсчета закона эквивалента
При соединении 3,5 г железа с серой образовалось 5,5 г сернистого железа. Вычислить эквивалент железа, если эквивалент серы равен 16.
Из данных задачи видно, что в сернистом железе на 3,5 весовых частей железа приходится 5,5 — 3,5 = 2 весовых части серы. А так как эквивалентом железа является такое весовое его количество, которое соединяется с одним эквивалентом серы, то
Так как многие элементы образуют по нескольку соединений друг с другом, то очевидно, что эквивалент элемента может иметь различные значения, смотря по тому, из состава какого соединения он был вычислен. Но во всех таких случаях различные эквиваленты одного и того же элемента относятся друг к другу как небольшие целые числа.
Например, эквиваленты углерода, вычисленные из состава его соединений с кислородом, равны 3 и 6, а отношение между ними 1 : 2.
Понятие об эквивалентах распространяется также и на сложные вещества.
Эквивалент сложного вещества
Эквивалентом сложного вещества называется такое весовое количество его, которое взаимодействует без остатка с одним эквивалентом водорода (1,008 вес. ч.) или кислорода (8 вес. ч.) или вообще с одним эквивалентом любого другого вещества.
Пример, при пропускании водорода над накаленной окисью меди 1 г водорода восстанавливает 40 г окиси меди. Последнее число и является эквивалентом окиси меди. Эквивалент серной кислоты равняется 49, так как 49 вес. ч. серной кислоты взаимодействуют без остатка с одним эквивалентом магния, цинка и других металлов. В свою очередь, окись меди и серная кислота будут взаимодействовать друг с другом без остатка, если на 40 вес. ч. окиси меди взять 49 вес. ч. серной кислоты.
Статья на тему Закон эквивалентов

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.