Теория:
Валентность и степень окисления Бериллия (Be) — это способность элемента образовывать химические связи и приобретать соответствующий условный заряд в соединениях.
Это металл из II группы, который наглядно демонстрирует, как постоянная валентность всегда приводит к фиксированной степени окисления из-за его сильной тенденции отдавать электроны.
Поэтому в абсолютном большинстве соединений бериллий проявляет постоянную валентность II (два).
Степень окисления во всех стабильных соединениях (таких как BeCl2 или BeO) равна +2, так как Бериллий отдает свои два внешних электрона.
Он не может принимать другие значения СО в стабильных соединениях, поскольку для образования СО = +1 или СО = +3 потребовалась бы неестественно высокая энергия.
Зависимость степени окисления от валентности бериллия
Для бериллия (Be) прямая зависимость между численным значением степени окисления и валентности очень очевидна и постоянна, поскольку бериллий является металлом, который всегда стремится отдать электроны.
Его электронная конфигурация — 1s2 2s2. На внешнем уровне находится 2 электрона, и он отдает их оба, чтобы достичь стабильной оболочки Гелия.
Валентность (II) создает структурную основу — она определяет, что Бериллий всегда образует две связи (как в Cl — Be — Cl или O = Be).
Степень окисления (+2) реализует эту возможность в виде условного заряда во всех стабильных соединениях (оксидах, солях).
Поскольку бериллий, как металл, всегда отдает электроны, его СО всегда положительна +2. Другие значения СО +1 или +3 невозможны в устойчивых химических соединениях.
Таким образом, численное значение валентности (2) всегда совпадает с численным значением степени окисления (2), и последняя имеет положительный знак (например, в хлориде бериллия V = II и СО = +2).
Валентность (V) бериллия
Валентность бериллия (то есть, число химических связей, которые он может образовать) в абсолютном большинстве его соединений постоянна и равна II (двум).
Это обусловлено тем, что атом бериллия находится во II группе и имеет два внешних электрона (2s2).
Для достижения стабильной завершенной оболочки Гелия (He) он всегда стремится использовать оба этих электрона для образования именно двух связей.
➡️ Валентность II (Два)
Используются два внешних электрона для формирования двух связей (двух общих электронных пар).
Две одинарные связи:
Пример: в хлориде бериллия (BeCl2, в газовой фазе). Бериллий связан с двумя атомами хлора.
Cl — Be — Cl
Одна двойная связь:
Пример: в оксиде бериллия (BeO). Бериллий связан с атомом Кислорода двойной связью.
O = Be
➡️ Исключения:
Валентность бериллия всегда остается II (два) и не меняется, поскольку он является металлом, который всегда стремится избавиться от обоих внешних электронов.
Устойчивых соединений, где Be проявлял бы валентность I или III, не существует.
Валентность бериллия (то есть, число химических связей, которые он может образовать) в подавляющем большинстве его соединений постоянна и равна II (двум).
Это обусловлено тем, что атом бериллия имеет два внешних электрона и для достижения стабильной завершенной оболочки ему нужно использовать оба этих электрона.
Он всегда стремится образовать именно две связи.
Степень окисления (СО) бериллия
Степень окисления бериллия (условный заряд) прямо связана с его валентностью (II), но из-за его природы как металла и низкой электроотрицательности, она всегда положительна.
Бериллий является щелочноземельным металлом, который стремится отдавать свои два внешних электрона.
➡️ СО = +2: Единственное устойчивое состояние
Это единственное устойчивое и распространенное состояние Бериллия в химических соединениях.
Это основное состояние, в котором Бериллий отдает два электрона (2e—), достигая стабильной электронной конфигурации Гелия.
Пример: в оксиде бериллия (BeO).
СО (Be) = +2, СО(O) = -2
Пример: в хлориде бериллия (BeCl2).
СО (Be) = +2, СО (Cl) = -1
➡️ СО = +1 и другие: Неустойчивые состояния
Эти состояния не наблюдаются в устойчивых химических соединениях.
Ион Be+ крайне неустойчив и может существовать только в газовой фазе или в условиях высокой энергии, так как бериллий всегда стремится отдать оба своих внешних электрона.
Таким образом, для целей общей химии +2 — это постоянное значение СО для Бериллия.
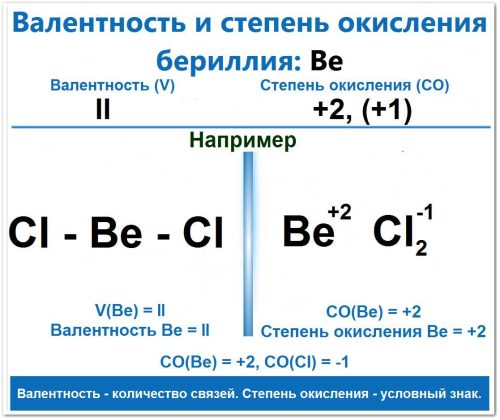
Валентность и степень окисления бериллия на примере
Валентность и степень окисления в BeCl2
✅ Валентность (V)
Валентность показывает число связей, которые образует атом.
Бериллий (Be): Как металл II группы, всегда имеет постоянную валентность II (два).
V (Be) = II
Хлор (Cl): В хлоридах с металлами Хлор всегда имеет постоянную валентность I (один).
V (Cl) = I
Структура (газовая фаза): Cl — Be — Cl (Линейная молекула).
✅ Степень окисления (СО)
Степень окисления показывает условный заряд атома, предполагая ионные связи.
Бериллий (Be): Отдает свои два внешних электрона.
СО (Be) = +2
Хлор (Cl): Принимает один электрон. Для баланса в молекуле BeCl2 должно быть два атома Cl (так как (+2) + 2 Х (-1) = 0.
СО(Cl) = -1
✅ Обозначение
Показатель степени окисления над формулой:
Be+2Cl2-1
Пример решения, задача:
▶️ Дано:
Соединение: пероксид бериллия (BeO2).
Тип: Это пероксид, а не оксид, что влияет на кислород.
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Степень Окисления (СО) Бериллия (Be): Бериллий — щелочноземельный металл (II группа), всегда имеет СО = +2 в соединениях.
Степень Окисления (СО) Кислорода (O): В пероксидах (соединения с группой O-O с общим зарядом -2), каждый атом кислорода имеет СО = -1.
Проверка баланса: (+2) + 2 x (-1) = 0.
Валентность (V) Бериллия (Be): Всегда образует две связи: V = II.
Валентность (V) Кислорода (O): В пероксидах каждый атом кислорода образует две связи (O—O и O—Be), поэтому V = II.
✅ Ответ:
Его валентность равна II (два) +2, степень окисления II (два) -1 .
Часто задаваемые вопросы:
Основные значения валентности и степени окисления являются фиксированными и постоянными в его устойчивых соединениях:
Валентность (V): II (два). Степень Окисления (СО): +2.
Наиболее стабильным состоянием является его ионное состояние в химических соединениях — ион Be2+.
Отличается от его степени окисления (СО) только наличием знака.
В своих соединениях оба понятия имеют одинаковое численное значение, равное двум (2), что обусловлено наличием у него двух внешних электронов.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.