Теория:
Валентность и степень окисления кислорода (О) — это способность элемента образовывать химические связи и приобретать соответствующий условный заряд в соединениях.
Это неметалл из VI группы, который наглядно демонстрирует, как постоянная валентность может приводить к переменным степеням окисления из-за его крайне высокой электроотрицательности.
Поэтому в подавляющем большинстве соединений кислород проявляет постоянную валентность II (два).
Степень окисления в наиболее стабильных соединениях (оксидах, как Н2О) равна -2, но, будучи самым электроотрицательным элементом после Фтора.
Он может принимать и другие значения: -1 (в пероксидах), -1/2 (в супероксидах) и даже положительные +1, +2 (в соединениях с Фтором).
Зависимость степени окисления от валентности кислорода
Для кислорода (О) прямая зависимость между численным значением степени окисления и валентности существует, но она менее очевидна из-за его высокой электроотрицательности и наличия исключений.
Его электронная конфигурация — 1s2 2s2 2p4. На внешнем уровне находится 6 электронов, и ему не хватает двух электронов до стабильной оболочки.
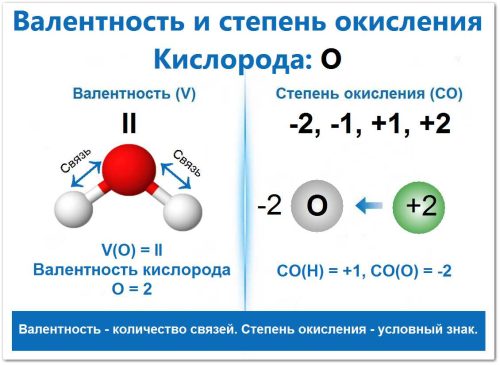
Валентность (II) создает структурную основу — она определяет, что кислород всегда образует две связи (как в Н—О—Н или О=С=О).
Степень окисления (-2) реализует эту возможность в виде условного заряда в подавляющем большинстве соединений (оксидов и воды).
Поскольку кислород, как очень электроотрицательный неметалл, принимает электроны, его СО почти всегда отрицательна (-2, -1). Только в соединениях с более электроотрицательным Фтором (F) его СО становится положительной (+1, +2).
Таким образом, численное значение валентности (2) почти всегда совпадает с численным значением степени окисления (2), но последняя имеет отрицательный знак (например, в воде V = II и СО = -2).
Валентность (V) кислорода
Валентность кислорода (то есть, число химических связей, которые он может образовать) в подавляющем большинстве его соединений постоянна и равна II (двум).
Это обусловлено тем, что атом кислорода имеет шесть внешних электронов и для достижения стабильной завершенной оболочки ему не хватает двух электронов.
Он всегда стремится образовать именно две связи.
➡️ Валентность II (Два)
Используются два внешних электрона для формирования двух связей (двух общих электронных пар).
Две одинарные связи: Пример: в воде (Н2О). Кислород связан с двумя атомами водорода.
H — O — H
Одна двойная связь: Пример: в диоксиде углерода (СО2). Кислород связан с атомом Углерода двойной связью.
O = C = O
➡️ Исключения: валентность кислорода остается II даже в менее распространенных соединениях, таких как пероксиды:
Пример: в пероксиде водорода (Н2О2). Каждый атом кислорода образует две связи: одну с водородом (Н) и одну с другим атомом кислорода (О).
H — O — O — H
Валентность кислорода (то есть, число химических связей, которые он может образовать) в подавляющем большинстве его соединений постоянна и равна II (двум).
Это обусловлено тем, что атом кислорода имеет шесть внешних электронов и для достижения стабильной завершенной оболочки ему не хватает двух электронов.
Он всегда стремится образовать именно две связи.
Степень окисления (СО) кислорода: -2, -1, +1, +2
Степень окисления кислорода (условный заряд) тесно связана с его валентностью (II), но из-за своей высокой электроотрицательности в подавляющем большинстве соединений она отрицательна.
Кислород является сильным неметаллом, который стремится принимать электроны.
СО = -2: Наиболее устойчивое и распространенное состояние
Это основное состояние, в котором Кислород принимает два электрона, достигая стабильности.
Пример: в воде (Н2О). СО(О) = -2, СО(Н) = +1.
Пример: в диоксиде углерода (СО2). СО(О) = -2, СО(С) = +4.
СО = -1: Менее устойчивое состояние
Это состояние характерно для пероксидов (O — O), где каждый атом O принимает только один электрон.
Пример: в пероксиде водорода (Н2О2). СО(О) = -1, СО(Н) = +1.
СО = +2: Единственное положительное состояние
Это самое редкое состояние, которое возникает только тогда, когда кислород связан с более электроотрицательным элементом — Фтором (F).
Пример: во фториде кислорода (OF2). СО(О) = +2, СО(F) = -1.
Валентность и степень окисления на примере воды Н2О
Валентность (V): Валентность Кислорода (О) в Н2О постоянна и равна II (двум). Это значит, что О образует две химические связи (Н — О — Н).
Степень окисления (СО): Степень окисления кислорода в Н2О равна -2.
Это происходит, потому что О (сильный неметалл) принимает два электрона от водорода (Н), приобретая условный заряд -2.
Численное значение валентности (2) совпадает с численным значением СО (2), но СО имеет отрицательный знак. СО(О) = -2, СО(Н) = +1.
Пример решения, задача:
▶️ Дано:
Соединение OF2 (фторид кислорода).
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Валентность (V): V (О) = II.
Степень Окисления (СО): Фтор (F) всегда имеет СО = -1.
Для нейтральности: СО = O + 2 х (-1) = 0. СО (O) = +2.
✅ Ответ:
Его валентность OF2 (фторид кислорода) равна 2, степень окисления +2.
Часто задаваемые вопросы:
Как неметалл, проявляет валентность II (наиболее часто), а также III (в ионе оксония).
Соответствующие им степени окисления — -2 (наиболее часто), -1 (в пероксидах) и +2 (только с фтором).
Наиболее стабильным состоянием кислорода является степень окисления 0 (валентность II) в виде двухатомной молекулы O2.
Валентность (II, III) — это фактическое количество химических связей, которые может образовать атом кислорода.
Степень окисления (-2, -1, 0, +2) — это условный заряд атома кислорода, который он приобретает в соединении.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.