Теория:
Менделевий (Md) занимает положение в 7‑м периоде, что во многом определяет его радиоактивную и химическую природу.
Будучи актиноидом (аналогом тулия из ряда лантаноидов), этот элемент проявляет свойства, характерные для тяжёлых металлов, при этом его наиболее стабильное состояние в растворах — степень окисления +3.
Принадлежность к семейству актиноидов (или ряду 5f-элементов) задаёт его ключевые параметры:
- Валентность III и II.
- Степени окисления +3 и +2 (последняя более достижима, чем у многих предшественников по ряду).
Химический облик элемента подтверждается его электронной архитектурой (конфигурацией):
[Rn] 5f13 7s2.
На основе этой формулы можно наглядно идентифицировать его как предпоследнего представителя семейства «внутренних» переходных элементов 7-го периода.
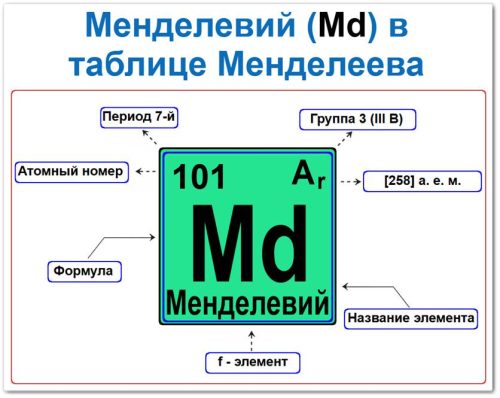
Менделевий (Md) — это f‑элемент, относящийся к группе актиноидов и 7‑му периоду.
Данная локация в таблице (периодической системе элементов) диктует, какова будет химическая активность и валентные возможности атома в экспериментальных условиях.
Как определить положение Менделевия в Таблице Менделеева
Местоположение менделевия в реестре элементов (системе классификации) задаётся его ядерными и электронными метриками — «химическим формуляром»:
- Порядковый номер (регистрационный номер в системе).
- Название и этимология.
- Семейство (актиноиды).
- Период (горизонтальный пласт).
- Электронное семейство (менделевий f ‑ элемент).
Порядковый номер / атомный номер (Z = 101)
- Служит уникальным кодом элемента в ряду трансурановых «тяжеловесов».
- Ядро содержит 101 протон; вокруг него в нейтральном состоянии вращается 101 электрон.
- Электронный паспорт: [Rn] 5f13 7s2.
Важно: Md стал первым элементом, синтезированным «поатомно», что подтвердило точность предсказаний великого русского химика.
Название и символ
- Название: «менделевий» (в знак признания заслуг Д. И. Менделеева, создателя периодического закона).
- Символ: Md.
Историческая справка: открыт американскими учёными (группа Сиборга) в 1955 году, что стало символом международного признания русской химической школы.
Семейство (Актиноиды)
Расположен в ряду актиноидов (между фермием и нобелием); согласно современной ИЮПАК-номенклатуре, относится к f-блоку.
Что это даёт атому:
- Заполнение глубокой 5f-оболочки (13 электронов).
- Валентность менделевия: доминирующая III, однако экспериментально доказана возможность перехода в состояние II (Md2+).
- Степени окисления: наиболее устойчивая +3, также возможна +2 и, в исключительных случаях, +1.
Период (7‑й)
Находится в 7‑м ряду — электроны распределены по семи энергетическим уровням (слоям).
Что это даёт элементу:
- Высокую энергию внешних 7s-электронов.
- Радиоактивность: все изотопы менделевия нестабильны; самый долгоживущий (Md-258) имеет период полураспада около 51 дня.
- Сходство: положение в 7-м периоде делает его химическим «близнецом» лантаноида Тулия (Tm), но с поправкой на большую радиоактивность.
Относительная атомная масса (Ar)
- Ar(Md) ≈ [258] (для наиболее стабильного нуклида).
- Значение: суммарное количество нуклонов в ядре самого устойчивого изотопа.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Валентные электроны или «достраивающиеся» уровни относятся к f-подуровню.
Важно: именно f-характер Менделевия обуславливает его сложное поведение в ионообменной хроматографии, что и позволило его идентифицировать при открытии.
Определение энергетических уровней Менделевия по Таблице Менделеева
Положение Менделевия (Md) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
Названный в честь создателя периодического закона, этот элемент занимает особое место в ряду тяжелых актиноидов, завершая путь к самым тяжелым ядрам таблицы.
1. 7-й период (Количество этажей)
Менделевий находится в седьмой строке таблицы. По фундаментальному закону химии: номер периода всегда равен количеству электронных слоев.
Итог: у Менделевия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Менделевия — 101. Его 101 электрон распределены по уровням следующим образом:
Md ) 2 ) 8 ) 18 ) 32 ) 31 ) 8 ) 2
Для сравнения: у соседа слева, Фермия (100), на 5-м уровне 30 электронов, а у Менделевия (101) — 31. Это постепенное заполнение глубокого 5f-подуровня характерно для всего семейства актиноидов.
3. 3-я группа (Химический характер)
Формально Менделевий относится к 3-й группе (как часть семейства актиноидов), располагаясь в одном вертикальном ряду со Скандием, Иттрием и Лантаном.
- f‑элемент: его химическая природа определяется заполняющейся 5f-оболочкой. Это делает его типичным тяжелым радиоактивным металлом.
- Место в блоке: Менделевий — первый элемент, для которого была открыта стабильная степень окисления +2 в растворах (помимо стандартной +3), что роднит его по поведению с представителями группы щелочноземельных металлов.
Проверка знаний: Как определить Менделевий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Менделевий (Md).
Показать верные ответы и пояснения
Верные ответы: 1, 2, 3
- 1) Номер 101. Это «прописка» элемента в системе, определяющая заряд его ядра.
- 2) Актиноид, 7 период. Менделевий — классический представитель поздних актиноидов.
- 3) Назван в честь Менделеева. Это единственный элемент, названный в честь Дмитрия Ивановика иностранными первооткрывателями.
Часто задаваемые вопросы:
Менделевий (Md) — искусственно полученный радиоактивный элемент с атомным числом 101. В природе не встречается.
Порядковый номер: 101. Группа: актиноиды (внизу таблицы). Период: 7-й.
Это металл, склонный к образованию ионов со степенью окисления +3 и +2.
Обладает крайне высокой радиоактивностью.