O кислород (Oxygenium) — химический элемент с порядковым номером 8 в периодической системе.
Находится во II периоде.
Температура плавления: -218.4 ℃. Плотность: 0.00133 г/см3. атомный номер 8, атомная масса 15, 9994.
Способен образовывать два простых вещества — кислород и озон.
Известны искусственные изотопы кислорода в диапазоне массовых чисел от 11 до 28.
Электронная формула
Электронная формула атома кислорода:
1s2 2s2 2p4
Сокращенная электронная конфигурация O:
[He] 2s2 2p4
Группа кислорода принадлежат к числу р-элементов, так как у них достраивается р-оболочка.
Электронно-графическая схема кислорода (О)
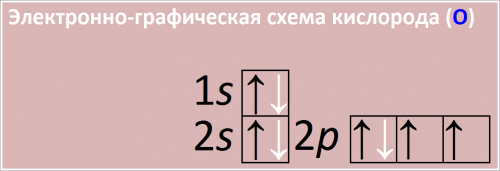
Рис. Схема распределения электронов по атомным орбиталям в атоме кислорода.
Энергетические уровни
Распределение электронов по энергетическим уровням в атоме кислорода О:
1-й уровень (K): 2
2-й уровень (L): 6

Рис. Распределение электронов по энергетическим уровням в атоме кислорода.
Валентные электроны кислорода
Количество валентных электронов в атоме кислорода — 6.
Таблица квантовых чисел азота (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 2 | 0 | 0 | +1/2 |
| s | 2 | 0 | 0 | -1/2 |
| p | 2 | 1 | -1 | +1/2 |
| p | 2 | 1 | 0 | +1/2 |
| p | 2 | 1 | 1 | +1/2 |
| p | 2 | 1 | -1 | -1/2 |
Степень окисления кислорода равна: −2 −1 +1 +2.
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 16O | 8 | 8 | 15.99491461956 |
| 17O | 8 | 9 | 16.9991317 |
| 18O | 8 | 10 | 17.999161 |
Природный кислород состоит из смеси трех стабильных изотопов:
- 16O (изотопная распространенность 99,76 %).
- 17O (изотопная распространенность 0,04 %).
- 18O (изотопная распространенность 0,20 %).
Самый долгоживущий радиоактивный изотоп — 15O, его период полураспада — 122,24 секунды.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.