Теория:
Алюминий (Al) — лёгкий и химически активный, но коррозионно‑стойкий металл, чьё химическое поведение определяется его положением в p‑блоке и наличием трёх валентных электронов.
Определение алюминия в периодической системе элементов основана на фундаментальных константах:
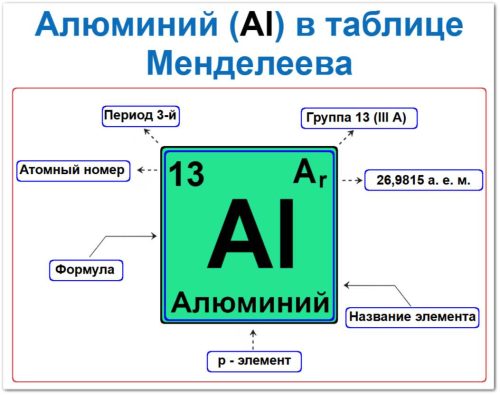
Атомный номер Z = 13 — определяет электронную конфигурацию [Ne] 3s2 3p1.
Местоположение: 3‑й период, 13‑я группа (III A).
Это положение диктует ключевые свойства:
- Наличие трёх валентных электронов (3s2 3p1).
- Единственная стабильная степень окисления +3.
- Амфотерность оксида и гидроксида.
Как определить положение алюминия в Таблице Менделеева
Положение алюминия в таблице задаётся несколькими фундаментальными характеристиками — своего рода «химическим паспортом»:
- Порядковый номер и атомный номер.
- Название элемента.
- Группа (вертикальный столбец).
- Период (горизонтальный ряд).
- Электронный блок, (алюминий p‑элемент).
Порядковый номер / атомный номер (Z = 13)
- Однозначно идентифицирует элемент.
- В ядре — 13 протонов; в нейтральном атоме — 13 электронов.
- Электронная конфигурация: 1s2 2s2 2p6 3s2 3p1 или [Ne] 3s2 3p1.
Примечание: Z = 13 находится сразу после магния (Z = 12) и открывает p‑блок 3‑го периода.
Название и символ
- Название: «Алюминий».
- Символ: Al (от лат. Aluminium).
Группа (13‑я / III A)
- Три валентных электрона (3s2 3p1).
- Степень окисления: +3 (например, Al2O3, AlCl3).
- Металлическая природа: типичный металл, но его оксид и гидроксид амфотерны (реагируют и с кислотами, и со щелочами).
Важно: отсутствие переменной валентности.
Период (3‑й)
Три энергетических уровня (K, L, M).
Особенности:
- Относительно лёгкий элемент.
- Больший радиус по сравнению с элементами 2‑го периода, что облегчает отдачу электронов.
- Наличие свободных 3d‑орбиталей, но они не используются для повышения валентности.
Относительная атомная масса (Ar)
Ar (Al) ≈ 26,9815.
Значение: средневзвешенное значение масс изотопов.
Уникальность: практически моноизотопный элемент, с одним стабильным изотопом — 27Al (13 протонов и 14 нейтронов).
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Последний электрон находится на p‑подуровне (3p1).
Свойства:
- Находится на границе между металлами и неметаллами (B, Si, As), что объясняет амфотерность.
- Высокая реакционная способность (легко окисляется на воздухе).
- Высокая коррозионная стойкость благодаря пассивирующей плёнке Al2O3.
Проверка знаний: Как определить водород по таблице Менделеева
Отметьте три правильных утверждения, которые однозначно определяют Алюминий (Al) в Периодической системе.
По каким признакам можно безошибочно установить, что речь идёт именно об Алюминии?
Показать верные ответы и пояснения
Правильные ответы: 1, 3, 4
- 1) В атомном ядре содержится ровно 13 протонов.
Это главный отличительный признак: число протонов (Z=13) однозначно задаёт химический элемент. - 3) Находится в 3-м периоде и 13-й группе (III ).
Такое сочетание положения в таблице уникально для алюминия и определяет:- три электронных слоя (период 3);
- три валентных электрона (группа 13);
- принадлежность к p-блоку.
- 4) Полный набор электронов описывается формулой: 1s2 2s2 2p6 3s2 3p1.
— Общее число электронов (13) совпадает с атомным номером (Z=13).
— На внешнем уровне (n = 3) — 3 электрона (3s2 3p1). - 2) Является амфотерным элементом.
Хотя это верно (амфотерность его оксида/гидроксида), признак не уникален. Амфотерность также проявляют Zn, Cr, Be, а также соседний Ga и In. - 5) Находится в 3-м периоде и имеет три электронные оболочки.
Верно, но не уникально. Все элементы 3-го периода (Na до Ar) имеют три слоя. - 6) Проявляет только одну степень окисления: +3.
Неверно: Хотя +3 доминирует, в редких газообразных и комплексных соединениях могут встречаться +1 и +2.
Часто задаваемые вопросы:
В 3‑м периоде, III группе (главная подгруппа), порядковый номер 13.
Заряд ядра: +13 (13 протонов).
Электронная конфигурация: 1s22s22p63s23p1 (на внешнем уровне 3 электрона).
Степень окисления: преимущественно +3.
Характер элемента: амфотерный металл (реагирует и с кислотами, и со щелочами).
Важное свойство: на воздухе покрывается защитной оксидной плёнкой Al2O3, что придаёт ему коррозионную стойкость.