Теория:
Водород (H) — элемент‑уникум, чьё химическое поведение полностью определяется его положением в s‑блоке (1s1).
Уникальность водорода — в двойственной химической природе: он способен проявлять свойства и щелочных металлов, и галогенов.
Идентификация водорода основана на фундаментальных константах:
-
Атомный номер Z = 1 — определяет число протонов в ядре (1 p⁺) и электронов в нейтральном атоме (1 e⁻).
-
Электронная конфигурация: 1s¹.
-
Местоположение: 1‑й период, 1‑я группа (I A).
Это положение диктует ключевые свойства:
-
Наличие одного валентного s‑электрона;
-
Способность проявлять степени окисления водорода +1 и −1;
-
Ограниченную валентность (I);
-
Склонность к образованию ковалентных связей.
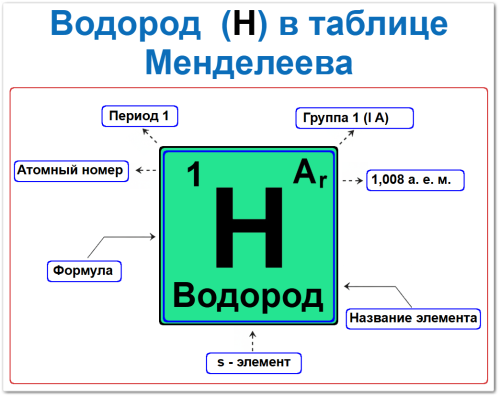
Как определить положение водорода в Таблице Менделеева
Положение водорода в таблице задаётся несколькими фундаментальными характеристиками — своего рода «химическим паспортом»:
- Порядковый номер и атомный номер.
- Название элемента.
- Группа (вертикальный столбец).
- Период (горизонтальный ряд).
- Электронный блок, (водород s‑элемент).
Порядковый номер / атомный номер (Z = 1)
-
Роль: однозначно идентифицирует водород.
-
В ядре — 1 протон; в нейтральном атоме — 1 электрон.
-
Электронная конфигурация: 1s1.
Примечание: изотопы водорода (¹H — протий, ²H — дейтерий, 3H — тритий) имеют разное число нейтронов, но одинаковый Z = 1. Химические свойства изотопов практически идентичны, а физические (плотность, температура кипения и др.) могут заметно различаться.
Название и символ
-
Название: «водород» (от греч. ὕδωρ — «рождающий воду»).
-
Символ: H (от лат. Hydrogenium).
Группа (1‑я / I A)
-
Один валентный электрон (1s1).
-
Степени окисления:
-
+1: отдаёт электрон, образуя H+ (например, HCl, H2O).
-
−1: принимает электрон, образуя гидриды (например, NaH).
-
Примечание: из‑за сходства с галогенами водород иногда условно помещают в 17‑ю группу (VII A). Это подчёркивает его двойственную природу: он может вести себя и как щелочной металл, и как галоген.
Период (1‑й)
-
Один энергетический уровень (K‑оболочка).
-
Особенности:
-
малый атомный радиус;
-
высокая энергия ионизации (1312 кДж/моль);
-
максимальная валентность строго ограничена I.
-
Относительная атомная масса (Ar)
-
Ar(H) = 1,008 (безразмерная величина).
-
Это средневзвешенное значение масс природных изотопов (1H, 2H).
Важно: водород стоит первым в таблице из‑за минимального Z = 1, а не из‑за массы. Это подчёркивает приоритет заряда ядра над массой при построении Периодической системы.
Все значения для всех элементов можно узнать в таблице атомных масс.
s‑Элемент (электронное семейство)
Относится к s‑блоку: единственный электрон на 1s‑подуровне.
Химические свойства:
-
-
Склонен образовывать ковалентные связи (H2, H2O, CH4);
-
При стандартных условиях — неметалл (газ);
-
Проявляет восстановительные свойства (отдаёт электрон) и окислительные (в реакциях с металлами, образуя гидриды).
-
Ключевое примечание о двойственной природе водорода
Благодаря электронной конфигурации 1s¹ водород занимает уникальное положение в таблице:
-
По числу валентных электронов он близок к щелочным металлам (группа I A);
-
По потребности в одном электроне до завершения оболочки — к галогенам (группа VII A).
Это объясняет его способность участвовать в самых разных типах химических реакций и делает его незаменимым элементом в химии.
Проверка знаний: Как определить водород по таблице Менделеева
Отметьте три правильных утверждения, которые однозначно определяют Водород (H) в Периодической системе.
По каким признакам можно безошибочно установить, что речь идёт именно о Водороде?
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) В атомном ядре содержится ровно 1 протон.
Это главный идентификационный признак: атомный номер Z = 1 однозначно задаёт водород как химический элемент. - 2) Находится в 1‑м периоде и 1‑й группе (I A).
Такое сочетание положения в таблице уникально для водорода и определяет:- одну электронную оболочку (период 1);
- один валентный электрон (группа 1);
- принадлежность к s‑блоку элементов.
- 3) Полный набор электронов: 1s1.
— Общее число электронов (1) совпадает с атомным номером (Z = 1).
— На внешнем уровне (n = 1) — 1 электрон.
— Краткая запись совпадает с полной, так как нет внутренних заполненных оболочек. - 4) Обладает двумя электронными оболочками.
Ошибка: водород находится в 1‑м периоде и имеет только одну электронную оболочку. - 5) Является самым лёгким из всех химических элементов.
Хотя это верно (атомная масса ≈ 1,008 а. е. м.), этот признак не является строго идентификационным с точки зрения периодической системы — он описывает физическое свойство, а не структурное положение. - 6) Может проявлять только положительную степень окисления +1.
Неверно: водород проявляет и степень окисления -1 (например, в гидридах металлов: NaH, CaH2).
Часто задаваемые вопросы:
Потому что у него 1 валентный электрон (1s1), как у щелочных металлов.
Но в отличие от них, водород — газ и не проявляет металлических свойств при н. у.
Атомный номер Z = 1 (1 протон в ядре).
Относительная атомная масса Ar (H)=1,008 (безразмерная величина, средневзвешенное для изотопов 1H, 2H).
Из‑за двойственной природы:
1. Может отдавать электрон (степень окисления +1, как металлы).
2. Может принимать электрон (степень окисления −1, как галогены).
3. Образует ковалентные связи (H2, H2O), а не ионные, как типичные элементы I A.
4. Стоит первым в таблице по Z = 1, а не по массе.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.