Скорость химической реакции
Для понимания химических процессов необходимо иметь представление о скорости химической реакции.
Скорость химической реакции определяется изменением концентрации исходных веществ в единицу времени.
Скорость химической реакции обозначим буквой υ, концентрацию — С. Рассмотрим процесс окисления двуокиси серы SО2 в трехокись, или серный ангидрид, SО3 под действием кислорода.
Эта реакция обратима и выражается уравнением:
2SО2 + О2 ⇄ 2SО3
Реакция, протекающая между первоначально взятыми веществами SО2 и О2, называется прямой, а разложение SО3 — обратной реакцией.
Если выразить концентрацию в молях на литр, то начальная концентрация SО2 равна Сl моль/л.
Через некоторый промежуток времени концентрация SО2 уменьшиться до О2 моль/л.
Понятно, что вместе с уменьшением концентрации SО2 уменьшается и концентрация О2, реагирующего с двуокисью серы, поэтому, говоря об изменении концентрации SО2, мы подразумеваем также изменение концентрации О2.
Изменение концентрации составит величину:
С2 — С1= — ΔС.
Для того чтобы определить среднюю скорость реакции υ, нужно определить изменение концентрации в единицу времени, т. е. если промежуток времени в секундах составит t2 — t1 = Δt сек.
То средняя скорость прямой реакции равна:
Например, если концентрация SО2 в начале реакции которая протекала 15 секунд, была 2 моль/л, а в конце — 0,5 моль/л, то средняя скорость прямой реакции:
Скорость реакции — величина положительная.
Знак минус указывает лишь на то, что по мере уменьшения концентрации исходных веществ (в частности, SО2 и О2) скорость прямой реакции замедляется.
Однако постепенно накапливается количество продукта реакции SО3, т. е. увеличивается его концентрация и начинается обратная реакция — разложение SО3.
Поскольку изменение концентрации здесь идет в сторону увеличения:
С2 — С1 = ΔС за период t2 — t1 = Δt,
то средняя скорость обратной реакции:
Из сказанного очевидно, что чем выше концентрация веществ в смеси, тем быстрее между ними идет реакция.
Другими словами, скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ.
Если концентрацию одного из исходных веществ А Обозначить [А], а концентрацию другого исходного вещества В обозначить [В], то зависимость скорости от концентрации веществ выразится формулой:
υ= k[A] · [B],
где k — коэффициент пропорциональности, называемый константой скорости.
Он равен такой скорости реакции, когда концентрация каждого из исходных веществ равна 1 моль/л.
Скорость химической реакции зависит прежде всего от концентрации исходных веществ.
Скорость реакции зависит от температуры (эта зависимость была отмечена Вант-Гоффом).
Как правило, скорость химической реакции резко возрастает с увеличением температуры.
Это объясняется тем, что молекулы реагирующих веществ получают дополнительную энергию (энергию активации), активизируются и быстрее реагируют друг с другом.
Очевидно, если смесь SO2 и O2 нагревать, то реакция между ними пойдет быстрее.
Для каждой реакции требуется разная энергия активации, после сообщения которой образование продуктов идет самопроизвольно и при этом выделяется энергия.
Если энергии выделяется меньше, чем было затрачено на активацию, то процесс эндотермичен, если больше, то экзотермичен.
Избыток энергии выделяется, а недостаток надо восполнять, поэтому эндотермические процессы требуют постоянного нагревания.
Для ускорения реакции между ионами в растворах требуется совсем небольшая энергия.
Скорость химической реакции зависит также от величины поверхности этих веществ: твердые вещества быстрее реагируют друг с другом в мелкораздробленном состоянии, а в растворах реакция идет еще быстрее.
➡️99. Что такое скорость химической реакции? В каких единицах она измеряется? (См. Ответ)
100. Какова зависимость скорости реакции от концентрации реагирующих веществ и какой формулой эта зависимость выражается?
101. Почему скорость реакции возрастает с увеличением температуры?
102. Чем объяснить, что одни реакции являются эндотермическими процессами, а другие — экзотермическими?
103. Почему твердые вещества для ускорения реакции между ними растворяют или растирают в мелкий порошок?
104. Почему для того, чтобы получить сульфид ртути из металлической ртути и серы, их растирают в ступке?
105. При смешивании твердого едкого натра и медного купороса никакой реакции не наблюдается. В растворе же между этими веществами реакция протекает практически мгновенно. Чем это объясняется? (См. Ответ).
Влияние катализатора на скорость химической реакции
Говоря о получении кислорода в лаборатории, мы упоминали, что для ускорения реакции разложения бертолетовой соли к ней добавляют двуокись марганца, которая является катализатором этой реакции.
Вещества, влияющие на скорость химической реакции, но к концу реакции остающиеся химически не измененными, называются катализаторами.
Реакции, протекающие в присутствии катализаторов, называются каталитическими. Процесс изменения скорости реакции под действием катализатора называется катализом.
Известны катализаторы, ускоряющие реакцию.
Например, пятиокись ванадия V2О5 в уже упоминавшейся нами реакции:
2SO2 + О2 ⇄ 2SO3
ускоряет образование продукта.
Такой катализ называется положительным.
Однако бывают случаи, когда требуется не ускорить, а, наоборот, замедлить реакцию, например коррозию металлов.
Для этой цели подбираются соответствующие замедлители реакции, их называют ингибиторами, а катализ — отрицательным.
Катализ может быть гомогенным и гетерогенным.
Гомогенный катализ
Гомогенный катализ наблюдается тогда, когда катализатор и реагирующие вещества находятся в одном и том же агрегатном состоянии — жидком или газообразном.
Примером такого катализа является окисление двуокиси серы кислородом в серный ангидрид в присутствии окиси азота NO.
Кислород, двуокись серы и окись азота являются газами.
Каталитическое действие окиси азота объясняется тем, что катализатор образует с одним из исходных веществ промежуточное соединение — двуокись азота:
2NO + О2 ⇄ 2NО2
Затем NО2 вступает в реакцию с двуокисью серы:
SО2 + NО2 ⇄ SО3 + NO
При этом NO2 опять восстанавливается в NО.
Ускорение реакции здесь происходит за счет того, что энергия, затраченная на активацию молекул в обеих реакциях, значительно меньше, чем энергия, затраченная на непосредственное взаимодействие двуокиси серы с кислородом.
Гетерогенный катализ наблюдается тогда, когда реагирующие вещества находятся в одном, а катализатор — в другом агрегатном состоянии.
Чаще катализатор бывает твердым, а реагирующие вещества жидкими или газообразными.
В качестве примера можно привести окисление двуокиси серы кислородом в присутствии пятиокиси ванадия V2О5.
Реакция происходит на поверхности катализатора. Немалую роль в этом играет явление адсорбции.
Поверхность катализатора неоднородна; в ней имеются группы молекул, образующие так называемые активные центры.
Количество их увеличивается с увеличением пористости или раздробленности катализатора.
Реагирующие друг с другом вещества адсорбируются этими активными центрами, образуя с ними нестойкие соединения, которые затем расщепляются с образованием молекул первоначальных веществ, но уже в активированном виде.
Активированные молекулы легче реагируют друг с другом, поэтому процесс ускоряется.
Если в сферу реакции попадает вещество, которое может образовывать стойкое соединение с катализатором, то, соединившись с ним, катализатор может утратить свою активность.
Такое вещество, называемое катализаторным ядом, как говорят, «отравляет» катализатор, поэтому катализатор защищают от «отравления».
Известны также вещества (промоторы), добавление которых в небольших количествах активизирует катализатор.
Следует особо отметить специфичность действия катализаторов: универсального катализатора, ускоряющего любую реакцию, не существует.
Для каждой реакции характерен свой катализатор.
Правда, иногда бывает так, что одно и то же вещество может ускорять несколько реакций.
Значение каталитических реакций
В современной химической промышленности подавляющее большинство процессов является каталитическими.
Переработка нефти, получение красителей, изготовление полимеров синтетического каучука, производство серной кислоты и аммиака не обходятся без катализаторов.
Говоря о катализаторах, нельзя не упомянуть о ферментных процессах, происходящих в живых организмах.
Ферменты — это сложные вещества белкового происхождения, обладающие узкоспецифическим действием.
Многие жизненные процессы, в том числе процессы пищеварения, без ферментов были бы невозможны.
Некоторые ферменты удается выделить в чистом виде и использовать в искусственных лабораторных и даже в промышленных условиях.
➡️ 106. Что такое катализатор, катализ, каталитические реакции, катализаторный яд?
107. Какие каталитические процессы вы можете указать и где катализ находит себе применение?
108. В чем отличие гомогенного катализа от гетерогенного? Приведите примеры.
109. Что такое ферментные процессы? (См. Ответ)
Химическое равновесие
Рассматривая скорость реакции 2SО2 + О2 ⇄ 2SO3
Мы говорили о том, что этот процесс обратимый, в котором имеет место не только прямая, но и обратная реакции.
Если с течением времени концентрации исходных веществ и скорость прямой реакции уменьшаются, то, скорость обратной реакции постепенно увеличивается, так как концентрация продукта реакции возрастает.
Когда скорости прямой и обратной реакций станут равными, наступит химическое равновесие:
υпр. = υобр.
Оно называется подвижным (динамическим) равновесием.
Такие реакции обычно не доходят до конца. Но равновесие может быть нарушено, или, как говорят, смещено.
Сместить равновесие можно в ту или иную сторону: в сторону образования продукта реакции — вправо или в сторону образования исходных веществ — влево.
Будучи смещенным, равновесие устанавливается снова, но уже на новом уровне.
Сместить равновесие можно с помощью следующих воздействий:
- Увеличением концентрации реагирующих веществ. Если в реакции увеличить концентрацию SО2 или SО3, то равновесие: 2SО2 + О2 ⇄ 2SО3 сместится в сторону образования SО3, трехокиси серы получится больше.
- Повышением температуры.
- Повышением давления (для газов). Поскольку SО2 и О2 — газы, то в данной реакции можно сместить равновесие вправо повышением давления.
По принципу Ле Шателье любое из воздействий способствует протеканию той реакции, которая его ослабляет.
Применим этот принцип к реакции синтеза аммиака NH3 из азота и водорода:
N2 + 3Н2 ⇄ 2NH3 + Q
Аммиак — это газ, являющийся продуктом равновесной реакции.
Рассмотрим влияние на эту реакцию всех трех факторов, влияющих на химическое равновесие.
- Если увеличить концентрацию водорода или азота, то это усилит реакцию, ведущую к снижению концентрации этих газов, т. е. сместит равновесие вправо — в сторону образования аммиака.
- Если повышать температуру, то, как видно из уравнения, поглощаться тепло будет при обратной реакции, поэтому равновесие сместится влево. Следовательно, если мы захотим с помощью температурных изменений повысить выход аммиака, смесь водорода и азота надо охлаждать.
- Для выяснения влияния давления следует разобраться, сколько молей газов в левой и в правой части. Согласно закону Авогадро, из 4 объемов газа в левой части равенства (3 объема водорода +1 объем азота) образуется 2 объема газа в правой части (2 объема аммиака).
Увеличение давления будет способствовать реакции, приводящей к уменьшению объема, равновесие сместится вправо, в сторону образования аммиака.
Уменьшение давления будет способствовать обратной реакции.
Если реакция идет без изменения объемов, то изменение давления не оказывает влияния на равновесие.
Применение обратимых процессов в промышленности невыгодно: слишком мал практический выход продукта реакции.
Стараются подобрать такие условия для этих реакций, чтобы как можно больше сместить равновесие в нужную сторону.
➡️110. Что такое химическое равновесие и почему оно называется подвижным? (См. Ответ)
111. Какие из перечисленных ниже факторов могут оказывать влияние на химическое равновесие: а) изменение температуры; б) давление; в) катализатор; г) изменение концентрации реагирующих веществ; д) увеличение поверхности реагирующих веществ.
112. В чем заключается принцип Ле Шателье? В какую сторону сместится равновесие в следующих процессах:
а) 2SO2 + О2 ⇄ 2SО3 + Q;
б) N2 + O2 ⇄ 2NO — Q;
в) 2NO + О2 ⇄ 2NО2 + Q;
г) РСl5 ⇄ РСl3 + Сl2 — Q.
при увеличении давления и при увеличении температуры. (См. Ответ)

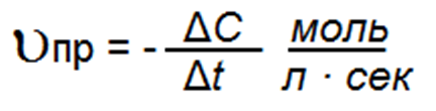
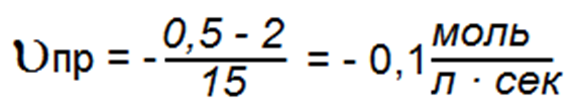
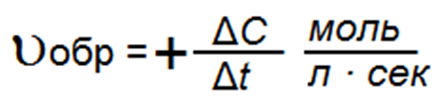
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.