Как зависит скорость химической реакции от условий
Установку демонстрируют в собранном, готовом для опыта виде или монтируют из готовых деталей на самом уроке. Этим обусловливается методический подход к интерпретации опыта.
Необходимо обеспечить хорошую видимость существенных частей установки и особенно тех внешних признаков и показателей, по которым судят о скорости реакции.
Чаще всего о скорости реакции делают заключение по наблюдениям, а также измерению количества выделяющегося газа при химической реакции.
Например, водорода при взаимодействии цинка разной степени измельчения с раствором серной кислоты разной концентрации при разных температурах или при разложении пероксида водорода без катализатора и в присутствии катализатора.
Можно также наблюдать разный уровень поднятия окрашенной жидкости в узких трубках под действием выделяющихся в результате реакции газов.
Деления должны быть хорошо видны учащимся, сидящим за последними лабораторными столами.
Отсчет времени (по метроному) ведут фронтально. Учитель записывает результаты на классной доске, а учащиеся — в лабораторных тетрадях.
Затем производят расчеты и чертят графики течения реакции во времени.
Дополнением к опыту служат схемы, показывающие прямую зависимость числа столкновений от числа реагирующих веществ.
Можно использовать (в классах с углубленным изучением химии) кривые распределения молекул по кинетической энергии при разных температурах (распределение Максвелла рассматривается в школьном курсе физики).
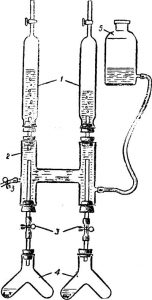
Рис 2. Установка для изучения зависимости скорости химической реакции от условий:
1— делительные воронки, 2 — Н-образный сосуд, 3 — зажимы, 4 — сосуды Ландольта, 5 — склянка с нижним тубулусом.
Для демонстрации зависимости скорости химической реакции от различных условий в школах имеется специальный прибор, выпускаемый промышленностью.
Влияние природы реагирующих веществ на скорость химических реакций
В одну пробирку наливают 10 мл раствора соляной кислоты (1 : 5).
А в другую — 10 мл раствора уксусной кислоты (1 : 5). Опускают одновременно в обе пробирки по 2 — 3 гранулы цинка. Сравнивают уровни жидкости в манометрических трубках.
Влияние концентрации реагирующих веществ на скорость химической реакции
В одну пробирку наливают 10 мл раствора серной кислоты (1 : 5).
А в другую —10 мл раствора той же кислоты (1 : 10). Опускают одновременно в обе пробирки по 2 — 3 гранулы цинка. Сравнивают уровни жидкости в манометрических трубках.
Влияние температуры на скорость химической реакции
В одну пробирку наливают 10 мл раствора серной кислоты (комнатная температура).
А в другую — такой же объем кислоты, нагретой до 50 °С. Раствор кислоты в обоих случаях приготовлен из расчета 1 : 5.
Опускают одновременно в две пробирки по 1 — 2 гранулы цинка.
По разности уровней окрашенной жидкости в манометрических трубках судят о скорости химической реакции.
Влияние поверхности соприкосновения реагирующих веществ на скорость химической реакции
В две пробирки наливают по 10 мл раствора серной кислоты (1 : 5).
- В одну пробирку опускают 1 гранулу цинка, а в другую — 1 пластинку.
- Во второй трубке наблюдают более быстрое поднятие жидкости.
Влияние катализатора на скорость химической реакции
В две пробирки наливают по 10 мл 3%-ного раствора пероксида водорода.
В одну пробирку вносят на кончике скальпеля оксид марганца (IV). Наблюдают быстрое поднятие уровня жидкости в манометрической трубке, соединенной с пробиркой, в которую помещен катализатор.
Чтобы доказать, что катализатор в результате реакции остался без изменений, сливают жидкость из пробирки, в которой находится катализатор.
Промывают его дистиллированной водой и наливают новый объем (10 мл 3%-ного раствора) пероксида водорода.
Наблюдают тот же эффект.
В качестве катализатора, кроме оксида марганца (IV), можно использовать оксид меди (II), оксид железа (III), оксид кремния (IV).
Влияние ингибитора на скорость химической реакции
В две пробирки наливают 10 мл серной кислоты (1 : 5). Опускают одновременно в них по 2 — 3 гранулы цинка.
Наблюдают движение столбиков окрашенной жидкости в обеих манометрических трубках.
В одну из пробирок добавляют таблетку (предварительно растертую) уротропина.
Через 1 — 2 мин наблюдают, что движение столбика жидкости в манометрической трубке, соединенной с пробиркой, в которую был добавлен ингибитор, резко замедлилось.
В качестве ингибитора можно использовать формалин (в одну пробирку добавить 1 мл формалина, а в другую — такой же объем дистиллированной воды, чтобы концентрации кислот в двух пробирках были одинаковы).
Меры безопасности при изучении скорости реакции
- Так как демонстрация опытов в данном приборе сопровождается выделением водорода, необходимо следить за тем, чтобы поблизости не было открытого огня.
- Опускание гранул цинка следует проводить по стенке, что-бы не пробить дно пробирки, а на дно пробирки положить кусочки резины или полиэтиленовых пробок.
- Необходимо соблюдать осторожность при работе, с кислотами.
- Во избежание выброса жидкости из манометрических трубок следует строго придерживаться тех количеств реактивов, которые рекомендованы при демонстрации опытов.
- Если жидкость начинает вытекать из манометрических трубок, необходимо приоткрыть пробки в пробирках.
- После окончания работы с прибором пробирки следует тщательно вымыть. Хранить прибор следует в чистом виде.
Для проведения опыта можно рекомендовать установку, собранную из набора НДХП, который имеется во многих школах.
Такая установка (рис. 2) имеет существенное преимущество по сравнению с выпускаемой промышленностью.
В ней вместо пробирок используются сосуды Ландольта, что позволяет смешивать реагирующие вещества друг с другом, не открывая пробок в пробирках-реакторах.
Если в нет готового набора НДХП, то опыт можно продемонстрировать, используя две колбы 1, две капельные воронки 2, два цилиндра 5, две чаши 4, как это изображено на рисунке, или продемонстрировать в установке, которую можно собрать, имея две бюретки.
Статья на тему скорость химических реакций


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.