Взаимодействие галогенов со сложными веществами
При взаимодействии свободных галогенов со сложными веществами они также ведут себя как окислители, примером может служить взаимодействие с водой.
Вначале галоген растворяется в воде с образованием соответственно хлорной, бромной или йодной воды (Cl2aq, Br2aq или I2aq), а затем постепенно между водой и галогеном начинается реакция.
Галогены с водой
Взаимодействие хлора с водой выражается конечным уравнением
Сl2 + H2O = 2НСl + [О]
Однако эта реакция не сразу протекает до образования конечных продуктов. На первой стадии процесса образуются две кислоты — соляная НСl и хлорноватистая НСlO:
Затем происходит разложение хлорноватистой кислоты:
Образованием атомарного кислорода объясняют в значительной мере окисляющее действие хлора, которое он оказывает на микроорганизмы, находящиеся в воде, вследствие чего они погибают.
Выделение атомарного кислорода объясняет также отбеливающее действие хлора, которое он оказывает на предварительно увлажненные органические вещества.
Органические красители, помещенные в хлорную воду, обесцвечиваются.
Лакмус, который при наличии соляной кислоты должен окрашиваться в розовый цвет, в хлорной воде, где в небольших количествах присутствует соляная кислота, не приобретает характерной для него в кислоте окраски, а полностью теряет ее.
Это объясняется наличием атомарного кислорода, который оказывает на лакмус окисляющее действие.
Аналогично реагируют с водой и другие галогены: бром и иод — более медленно, фтор — значительно быстрее и энергичнее.
Пары воды горят во фторе, а стадии образования кислородной кислоты у фтора нет, либо такая кислота не существует.
Галогены реагируют и с органическими веществами.
Галогены и органические вещества
Примером может служить хлор, если внести в его атмосферу бумажку, смоченную скипидаром (органическое вещество, состоящее из водорода и углерода).
То можно заметить выделение большого количества сажи и ощутить запах хлористого водорода.
Иногда скипидар даже самовоспламеняется в хлоре.
Хлор вытесняет углерод из соединения с водородом и образует хлористый водород, а углерод выделяется в виде сажи в свободном состоянии.
Все галогены энергично взаимодействуют с каучуком и резиной. По этой причине при работе с галогенами стараются не использовать в приборах резиновых деталей.
Среди реакций с органическими веществами важно отметить реакцию иода с крахмалом, который синеет при наличии в растворе даже незначительного количества свободного иода.
Реакция крахмала с иодом очень чувствительная и является качественной реакцией на иод.
Особый интерес представляют окислительно-восстановительные реакции галогенов, происходящие между свободным галогеном и солью другого галогена.
Примером может служить раствор какого-либо бромида и смешать с хлорной водой, то бесцветный раствор мгновенно окрашивается в желтый цвет.
При взбалтывании с бензолом характерная окраска бензольного кольца указывает на наличие свободного брома.
Это объясняется тем, что хлор как более активный галоген окисляет бром, вытесняя его из соли по уравнению:
2КВr + Cl2 = 2КСl + Вr2
Естественно, что свободный галоген должен обладать большей окислительной активностью, чем галоген, входящий в состав соли поэтому возможны реакции между иодидом и бромом, иодидом и хлором, бромидом и хлором.
Некоторые из этих реакций находят применение в технике.
Например, наиболее дешевым способом получения брома является вытеснение его хлором из солей, часто из бромида магния:
MgBr2 + Сl2 = MgCl2 + Вr2
►17. Докажите, составив электронный баланс, что взаимодействие галогенов с водой и с солями других галогенов является окислительно-восстановительными реакциями, и объясните, почему хлорная вода обладает обеззараживающим действием. (См. Ответ)
Окислительное свойства со сложными веществами
Окислительное действие галогенов проявляется и при реакциях с другими сложными веществами.
Примером может служить бромная вода и через нее пропускать сероводород, то очень скоро бромная вода обесцветится и образовавшаяся жидкость помутнеет вследствие восстановления Вr0 до Вr-1 и окисления S-2 до S0.
Иод довольно легко окисляет серу в степени окисления +4, например в Na2SO3, до S+6.
Схема реакции:
Na2SO3 + I2 → Na2SO4 + HI
► 18. Составьте уравнения окислительно-восстановительных реакций между бромом и сероводородом, а также между иодом и сульфитом натрия. (См. Ответ)
19. Составьте и заполните таблицу:
|
Химические свойства галогенов
|
Фтор F
|
Хлор Сl
|
Бром Вr
|
Иод I
|
|
1. Убывание электроотрицательности (указать стрелкой направление убывания)
2. Взаимодействие с водородом (уравнение реакции с указанием условий и названием продуктов реакции)
3. Взаимодействие с металлами (привести по одному уравнению реакции с указанием названий продуктов реакции)
4. Взаимодействие с водой (уравнения реакций)
5. Убывание окислительной активности (указать стрелкой направление убывания)
|
20. Сколько брома может быть получено из 92 г бромида магния вытеснением хлором, если выход брома равен 80% от теоретического?
21. В одном сосуде находится иоднай вода I2aq, в другом — бромная вода Br2aq. Какими двумя способами можно определить, где какой раствор?
22. Составьте подробный рассказ о физических и химических свойствах брома по следующему плану:
а) Агрегатное состояние;
б) Плотность;
в) Цвет,
г) Запах,
д) Температура кипения и плавления;
е) Растворимость в воде и других растворителях;
ж) Поведение в окислительно-восстановительных реакциях и место среди других галогенов по электроотрицательности и неметаллической активности;
з) Взаимодействие с простыми веществами, условия взаимодействия и продукты взаимодействия;
и) Взаимодействие со сложными веществами. (См. Ответ)
Способы получения хлора
Наиболее широко применяемый в народном хозяйстве хлор в промышленности получают путем электролиза растворов или расплавов поваренной соли.
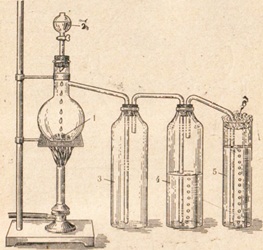
В лаборатории хлор получается путем различных окислительно-восстановительных реакций, примером может служить окисление соляной кислоты двуокисью марганца (рис.).
Соляную кислоту в данном случае берут концентрированную, реакцию ведут при слабом нагревании, а кислоту подают порциями.
С помощью такого прибора можно получить одновременно свободный хлор и хлорную воду. Избыток хлора поглощается щелочью.
Из-за сильной ядовитости хлор получают обязательно под тягой.
Кроме того, при получении хлора нужно включать в прибор как можно меньше резиновых деталей, так как резина сильно разъедается хлором и быстро выходит из строя.
В таком же приборе вместо МnO2 можно использовать перманганат калия КМnO4. Тогда реакция идёт без нагревания и намного быстрее.
Схема реакции:
КМnO4 + НСl → Сl2 + …
Можно использовать и другие окислители, например:
К2Сr2O7 + НСl → Сl2 + …
► 23. С помощью составления электронного баланса закончите все три уравнения реакций лабораторного получения хлора. (См. Ответ)
Применение
Фтор получают электролизом соли KHF2, а другие галогены получают путями, сходными с получением хлора.
Следует отметить, что бром обычно получают вытеснением из MgBr2 хлором, а иод вытесняют хлором из иодидов.
Свободный хлор широко применяется при уничтожении грызунов — вредителей сельского хозяйства. Впустив хлор в норку грызуна, плотно закупоривают ее и вредитель погибает.
Как уже сказано, хлор применяется для хлорирования водопроводной воды.
В промышленности он используется для получения синтетической соляной кислоты, хлорной извести, бертолетовой соли, извлечения благородных металлов из их руд, а также в реакциях органического синтеза.
Рис. Прибор для получения хлора лабораторным способом. 1 — двуокись марганца; 2 — капельная воронка с концентрированной соляной кислотой; 3 — сосуд для собирания хлора; 4 — сосуд с водой для получения хлорной воды; 5 — концентрированный раствор едкого кали; 6 — вата.
В медицине иод употребляется как наружное для местных прижиганий в виде йодной настойки или раствора Люголя, иногда в составе йодоформа СНI3.
При некоторых заболеваниях иод прописывается в виде свободного иода или его соединений. Лучше всего вводить иод в составе органических веществ.
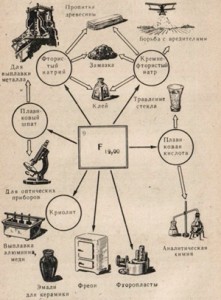
Фтор применяется в производстве пластических масс, таких, как тефлон, который устойчив к действию крепких кислот и щелочей.
Тефлон сохраняет свойства как при высоких, так и при низких температурах. Тефлон обладает хорошими изоляционными свойствами, эластичностью.
На основе фторорганических соединений изготовляют смазочные масла для работы при высокой температуре, вещества для борьбы с вредителями сельского хозяйства, для изготовления красителей, получения низких температур и т. д.
О применении фтора можно судить по схеме, изображенной на рис 2.
• Запишите в тетрадь, в каких областях хозяйства применяется фтор.
Бром и иод применяются также в виде солей, о чем будет сказано ниже.
►24. К двуокиси марганца прилили 200 мл 36% соляной кислоты. Образовавшийся хлор пропустили через раствор бромида калия.
Сколько брома было вытеснено? (Эта задача решается с применением последовательно двух уравнений, а также осложнена применением раствора процентной концентрации, плотность которого надо определить по таблице).
25. Какой объем хлора может быть получен при взаимодействии 2 молей хлористого водорода и 3 молей двуокиси марганца? (См. Ответ)
Галогеноводороды
Галогеноводороды — это соединения, типичные для всех галогенов. Их формулы: HF, НСl, HBr, HI. Степень окисления галогенов в этих соединениях —1.
Молекулы галогеноводородов построены по полярному типу связи. Все они очень хорошо растворимы в воде и в растворе диссоциируют как кислоты.
Хлористый водород (хлороводород)
Наибольшее практическое значение имеет хлористый водород. Это бесцветный газ с резким характерным запахом.
Вдыхание хлористого водорода резко раздражает слизистые оболочки и вызывает сильный кашель.
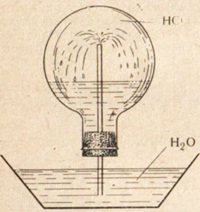
Хлористый водород, как и хлор, тяжелее воздуха, но главной особенностью его физических свойств является чрезвычайно высокая растворимость: в 1 объеме воды растворяется 500 объемов хлористого водорода.
Если собрать хлористый водород в сосуд (рис. 3), закупорить его пробкой с прямой стеклянной трубкой и опустить трубку в ванну, наполненную водой, то очень скоро вода из трубки будет бить фонтаном вверх в сосуд.
Это происходит потому, что в первых попавших в сосуд каплях воды растворился весь хлористый водород, заполнявший сосуд.
В сосуде образовалось разреженное пространство, куда под действием атмосферного давления с силой устремилась вода.
Высокой растворимостью хлористого водорода и объясняется разъедающее действие, которое он оказывает на слизистые оболочки, так как при растворении он образует соляную кислоту.
Получают хлористый водород двумя способами: лабораторным и синтетическим способом.
1. Лабораторный способ
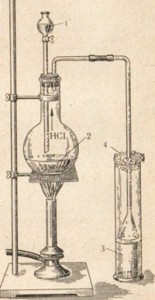
По этому способу хлористый водород получают действием серной кислоты на соль соляной кислоты (рис. 4).
Чаще всего для этой цели берут поваренную соль:
2NaCl + H2SO4 = Na2SO4 + 2HCl
Серную кислоту применяют концентрированную, а поваренную соль — кристаллическую.
Реакция хорошо идет и без нагревания, но в случае необходимости сосуд с реакционной смесью можно слегка подогреть.
Рис. 4. Прибор для получения соляной кислоты лабораторным способом.
1 — капельная воронка с концентрированной серной кислотой; 2 — поваренная соль; 3 — вода для поглощения хлористого водорода; 4—вата.
Необходимо следить, чтобы все части прибора были сухими, так как во влажной посуде получению хлористого водорода мешает его высокая растворимость.
Образующийся при реакции хлористый водород следует растворить в воде для получения соляной кислоты.
Этот способ применялся долгое время и в промышленности, но сейчас его вытесняет более прогрессивный синтетический метод получения хлористого водорода и соляной кислоты.
2. Синтетический способ
Химизм этого процесса очень несложен
Н2 + Сl2 = 2НСl.
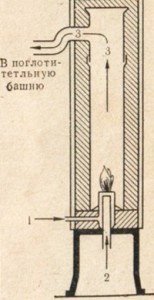
Процесс ведется при сгорании водорода в хлоре в специальных печах-горелках (рис. 5).
Из печи хлористый водород поступает в поглотительную башню, где улавливается водой, стекающей по насадке башни навстречу газу.
Получается концентрированная соляная кислота.
Другие галогеноводороды получают аналогично лабораторному способу получения НСl и весьма сходны с ним по свойствам.
Рис. 5. Печь-горелка для синтеза хлористого водорода. 1- водород; 2 — хлор; 3 — хлористый водород.
► 26. Напишите уравнения реакций получения:
а) Хлористого водорода из хлорида натрия;
б) Фтористого водорода из фторида кальция;
в) Бромистого водорода из бромида калия;
г) Йодистого водорода из иодида натрия. (См. Ответ)
Часто задаваемые вопросы и ответы?
Благодаря своим свойствам, они реагируют почти со всеми веществами, а также с некоторыми органическими веществами, примером может служить скипидар и каучук.
Когда они реагируют с другими веществами, примером может служить натрий, в результате чего образуются соли (хлорид натрия, фторид натрия, йодид натрия).
Образуются галогеновые кислоты, такие как соляная кислота (HCl) и фтористоводородная кислота (HF). Реакция обычно экзотермическая, то есть с выделением тепла.


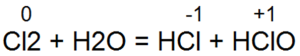
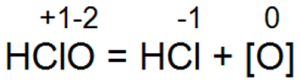
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.