Хлороводород получают прямым взаимодействием водорода Н2 и хлора Cl2 по реакции:
H2 + Cl2 → 2HCl
В лабораторных (домашних условиях) ее можно получить действием концентрированной серной кислоты на ее соли например хлорид натрия:
H2SO4 + 2NaCl → HCl↑ + Na2SO4
Реакция идет при нагревании.
Демонстративные опыты в типовых приборах и установках для получения хлороводорода
Одни и те же предметы учебного оборудования (химическая посуда, лабораторные принадлежности и др.) используют для демонстрации опытов в различных темах школьного курса.
Это относится не только к таким предметам оборудования, как пробирки или колбы, но и к отдельным приборам и целым установкам.
В одинаковых или лишь в нескольких видоизмененных приборах и установках можно получить хлороводород и хлор; провести каталитическое окисление оксида серы (IV) в оксид серы (VI) и аммиака до оксида азота (IV).
В универсальной горелке можно продемонстрировать горение водорода, аммиака, метана, оксида углерода (II) в кислороде, синтез хлороводорода.
Ниже даны в качестве примеров описания получения хлороводорода некоторых демонстрационных экспериментов с использованием приборов, а также их сочетаний друг с другом в более сложные установки.
Получение хлороводорода и получение соляной кислоты
Собирают установку (рис.) и проверяют ее на герметичность.
Пускают умеренный ток водорода и после вытеснения из воронки 2 воздуха (проба на чистоту) поджигают газ у отверстия универсальной горелки 1, помещенной под стеклянной воронкой 2.
Затем пускают слабый ток хлора так, чтобы водород находился в избытке.
Почти бесцветное пламя водорода в воздухе, после пуска хлора приобретает бледно-зеленый цвет.
При этом образуется белый туман, который уносится в нижнюю часть колонки, где он постепенно поглощается водой, стекающей сверху, т. е. газ и вода поступают с противоположных направлений.
Регулируют пламя поступлением водорода и хлора через промывные склянки с концентрированной серной кислотой (по числу пузырьков газа).
Включают водоструйный насос и приливают из капельной воронки 3 воду в поглотительную колонку 4, откуда жидкость вытекает в приемник 5.
Из стакана переливают жидкость снова в капельную воронку, и такую циркуляцию проводят 2—3 раза. Выключают сначала ток хлора, а затем и водорода. Отключают водоструйный насос.
Измеряют объем образовавшейся соляной кислоты. Синтез хлороводорода осуществляется со значительным выделением теплоты.
В водном растворе хлороводорода устанавливается равновесие:
НСl ⇄ Н+ + Сl—
Пробу испытывают раствором нитрата серебра, лакмусом и другими индикаторами, металлическим магнием.
Обнаруживают в растворе ионы водорода и хлорид-ионы:
Ag+ + Cl— = AgCl↓
Mg + 2Н+= Mg2+ + H2↑.
Часть соляной кислоты нейтрализуют раствором щелочи:
Н+ + ОН— = Н2O
Уравнение реакции нейтрализации соляной кислоты:
НСl + NaOH = NaCl + Н2O
Зная массу гидроксида натрия в 1 мл взятого для реакции раствора щелочи и объем этого раствора, израсходованный на нейтрализацию образовавшегося объема соляной кислоты.
Можно рассчитать молярную концентрацию раствора соляной кислоты для ее нейтрализации по формуле:
Меры предосторожности при получении хлороводорода
При реакции получения хлороводорода используется хлор Cl2 который при вдыхании может привести к негативным последствиям.
При выполнении данного опыта необходимо тщательно соблюдать меры предосторожности: опыт необходимо выполнять в вытяжном шкафу.
Установку тщательно проверить на герметичность, а получившийся водород — на чистоту.
Быстрые ответы?
Хлороводород (хлористый водород, гидрохлорид, хлорид водорода), соединение хлора с водородом, HCl, молярная масса 36,4606 г/моль.
Это бесцветный газ с резким запахом, во влажном воздухе сильно дымит, по этим признакам иногда определяют ее.
В производственных условиях получение осуществляется в специальных установках, где водород непрерывно сгорает ровным пламенем в токе хлора, смешиваясь с ним непосредственно в факеле горелки.
Лабораторная установка по такому способу приведена выше.
Первый способ: водород и хлор: сжигание водорода в хлоре. Второй способ: нагревание твердого хлорида натрия с концентрированной серной кислотой.
Во втором способе можно использовать и другие хлориды, но так как хлорид натрия NaCl в природе встречается в больших количествах его используют для получения хлороводорода и соляной кислоты.
Хлороводород это газ который во влажном воздухе дымит и имеет формулу HCl, а соляная кислота это растворенный хлороводород в воде поэтому формулу HCl • Н2О.
Концентрированная соляная кислота, содержащая 36 – 38 % хлороводорода, дымит на воздухе, так как из неё выделяется газообразный хлороводород.


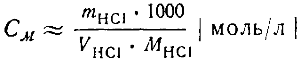
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.