Число Авогадро это количество составляющих частиц, обычно молекул, атомов или ионов, которые присутствуют в количестве материала, заданном одним молем.
Это аспект пропорциональности, который соотносит молярную массу материала с массой образца.
Он представлен символом NA или L, и имеет значение 6,022140857 × 1023 моль−1в Международной системе единиц измерения (СИ).
Что такое число Авогадро
Это число также называется константой Лошмидта в немецких работах. Константа Лошмидта позже была переопределена как число молекул в 12 граммах изотопа углерода-12 (12В), а еще позже всеобъемлющим, чтобы соотнести количество материала с их молекулярной массой.
Число Авогадро является безразмерным числом и имеет такое же арифметическое значение константы Авогадро, если оно задано в базовых единицах.
Безразличие к постоянной Авогадро имеет измерение взаимного количества материала.
Константа Авогадро также может быть записана или указана как 0,6023… мЛ⋅моль−1⋅Å−3, который может быть использован для изменения объема на атом в кубических ангстремах до молярного объема в миллилитрах на моль.
Неполный пересмотр базового набора единиц СИ потребовал пересмотра представлений о химическом количестве.
Возник на основе расчета, выполненного в середине 2018 года, в котором измерялось значение константы Авогадро NA = 6.022140758(62) ×1023 моль−1, переопределение компонентов СИ планируется ввести в действие 20 мая 2019 года.
Значение константы будет зафиксировано точно на 6,02214076×1023 моль.
История открытия числа Авогадро
Ученый Амедео Авогадро был тем, кто в 1811 году впервые предположил, что объем газа (при определенном давлении и температуре) пропорционален количеству молекул независимо от природы газа.
Французский физик Жан Перрен в 1909 году предложил назвать константу в память об Авогадро.
Перрин получил Нобелевскую премию в 1926 году по физике, главным образом за свою работу по формированию постоянной Авогадро с помощью некоторых различных подходов.
Значение постоянной Авогадро было впервые определено Иоганном Йозефом Лошмидтом, который оценил средний диаметр атома в воздухе методом, равным вычислению количества частиц в заданном объеме газа в течение 1865 года.
Это последнее значение, числовая плотность n0 частиц в идеальном газе, теперь известно как постоянная Лошмидта и связано с постоянной Авогадро, NA
или
Где R-газовая постоянная, p0-давление, а T0-абсолютная температура. Связь с Лошмидтом является источником символа L, который иногда используется для константы Авогадро.
В литературе на немецком языке обе константы могут называться одинаковыми именами, разница только в единицах измерения.
Точное вычисление числа Авогадро
Для точного определения постоянной Авогадро требуется вычисление одной величины как в молекулярном, так и в макроскопическом масштабах с использованием аналогичной единицы измерения.
Впервые это стало возможным, когда американский физик Роберт Милликен в 1910 году рассчитал заряд электрона.
Электрический заряд/моль электронов является константой, известной как постоянная Фарадея, и была известна с 1834 года, когда Майкл Фарадей распространил свои работы по электролизу.
Разделив заряд на моль электронов зарядом на один электрон, получают значение числа Авогадро.
С 1910 года новомодные расчеты более точно определили значения постоянной Фарадея и основного заряда.
Хотя необычно использовать единицы измерения количества материала, отличные от крота, константа Авогадро также может передаваться кротом в фунтах и кротом в унциях.
Постоянная Авогадро также входит в определение единой единицы атомной массы, u,
1u = (Mu/NA )1,660539(20) х 10 Кг
Учитывая, что Mu-постоянная молярной массы.
Измерение Кулонометрия
Первоначальный точный метод вычисления значения константы Авогадро был основан на кулонометрии.
Стандарт заключается в вычислении постоянной Фарадея F, которая представляет собой электрический заряд, за которым следует один моль электронов, и делится на элементарный заряд e, чтобы получить постоянную Авогадро.
Типичный эксперимент Бауэра и Дэвиса в NIST зависит от растворения металлического серебра вдали от анода электролизера при прохождении постоянного электрического тока I в течение определенного времени t.
Если m-масса серебра, потерянного с анода, и Ar-атомный вес серебра, то постоянная Фарадея показана:
Ученые NIST разработали метод, позволяющий компенсировать потерю серебра из-за механических причин с анода, и показали изотопный анализ серебра, используемого для регулирования его атомного веса.
F90 = 96485,39(13) C/моль-обычная постоянная Фарадея, которая напоминает значение константы Авогадро 6,0221449(78) × 1023 моль−1: оба значения имеют относительную регулярную неопределенность 1,3 × 10.
Измерение массы электронов
Комитет по данным для науки и техники (CODATA) публикует значения физических констант для глобального использования.
Он регулирует постоянную Авогадро из соотношения молярной массы электрона Аr(e)Mu к массе покоя электрона me:
Относительная атомная масса электрона, Ar(e), является непосредственно вычисленной величиной, а постоянная молярной массы, Mu, является известной постоянной в СИ. Масса покоя электрона, однако, измеряется по другим измеренным константам:
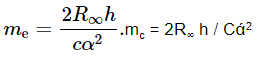
Международная координация Авогадро
Назначение проекта Avogadro является частью усилий по переопределению килограмма в выражениях универсальной физической постоянной, отличной от Международного прототипа Килограмма.
И уравновешивает измерения постоянной Планка с использованием весов для пищевых продуктов.
Современные определения Международной системы единиц (СИ) утверждают, что вычисление постоянной Авогадро является вторичным измерением постоянной Планка:
В расчете используются хорошо отполированные шарики из кремния весом в один килограмм. Шарики используются для упрощения измерения размера (и, следовательно, плотности) и для уменьшения эффекта оксидного покрытия, которое, безусловно, образуется на поверхности.
В первом расчете использовались шарики из кремния с естественным изотопным составом и имели относительную неопределенность 3,1×10.
Эти первые результаты также не соответствовали значениям постоянной Планка, полученным в результате расчета баланса кормов, хотя теперь считается, что источник несоответствия известен.
Измерения диаметра на шариках повторяются с точностью до 0,3 нм, а неопределенность в количестве составляет 3 мкг.
Полные результаты этих определений были предсказуемы в конце 2010 года. Их исследовательская работа, распространенная в январе 2011 года, содержала результаты IAC и представила расчет константы Авогадро, равной 6,02214078(18) ×1023 моль−1.
Часто задаваемые вопросы и ответы число Авогадро?
Каков физический смысл постоянной Авогадро?
Число Авогадро, конста́нта Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества.
Что такое постоянная Авогадро простыми словами?
Число́ Авога́дро, конста́нта Авогадро, постоянная Авогадро — физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Ранее определялось как количество атомов в 12 граммах (точно) чистого изотопа углерода-12.
Чему равна NA в физике?
Авогадро постоянная — (число Авогадро), число частиц (атомов, молекул, ионов) в 1 моле в ва. Обозначается NA и равна 6,022045±0,000031)·1023 . Химическая энциклопедия Авогадро постоянная — физ. величина NA, равная отношению числа молекул к количеству вещества: NА= (6,022 1367 ± 0,000 0036)·1023 моль 1.
Для чего число Авогадро?
Авогадро число NA = (6,022045±0,000031)·1023, число молекул в моле любого вещества или число атомов в моле простого вещества.
Одна из фундаментальных постоянных, с помощью которой можно определить такие величины, как, например, массу атома или молекулы (см. ниже), заряд электрона и т. д.
Чему равен 1 моль вещества?
Значение одного моля определяется через число Авогадро, один моль — количество вещества, содержащее 6,022 140 76⋅1023 частиц (атомов, молекул, ионов, электронов или любых других объектов).


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.