ЖЕЛЕЗО Fe (побочная подгруппа VIII группы)
Рассмотрим железо как представителя его семейства в побочной подгруппе VIII группы. Железо располагается в четвертом периоде.
Что такое железо
Атомный вес железа 55, 84, заряд ядра +26. Распределение электронов по энергетическим уровням (+26): 2, 8, 14, 2. Электронная конфигурация внешнего и предвнешнего слоя железа 3s23p63d64s2.
Таким образом, у атома железа, помимо двух s-электронов четвёртого внешнего слоя, имеется еще шесть d-электронов третьего предвнешнего слоя. Из этих d-электронов наиболее активны 4 неспаренных. Следовательно, в образовании валентных связей железа особенно активно участвует 6 электронов — 2 из внешнего и 4 из предвнешнего слоев. Наиболее распространенными степенями окисления железа являются Fe+2 и Fe+3. Железо — один из часто встречающихся в природе элементов. По распространенности среди остальных элементов оно занимает четвертое место.
- Исходя из строения атома железа, а также распределения электронов по орбиталям, укажите возможные степени окисления этого элемента. (См. Ответ)
Химические свойства металла
Железо в свободном состоянии представляет собой серебристо-серый блестящий металл с плотностью 7,87, температурой плавления 1535° и температурой кипения 2740°. Железо обладает ярко выраженными ферромагнитными свойствами, т. е. под воздействием магнитного поля намагничивается и при прекращении действия поля сохраняет магнитные свойства, само становясь магнитом. Такими свойствами обладают все элементы группы железа.
По химическим свойствам железо является весьма активным металлом. В отсутствие влаги железо на воздухе не изменяется, но при воздействии влаги и кислорода воздуха подвергается сильной коррозии и покрывается рыхлой пленкой ржавчины, представляющей собой гидроокиси железа, которые не защищают его от дальнейшего окисления, и железо постепенно окисляется во всей своей массе:
4Fe + 2Н2О + 3О2 = 2Fe2O3 · 2H2O
Разработан ряд методов защиты этого ценнейшего металла от коррозии.
Реакция железа с веществами
В ряду напряжений железо располагается левее водорода. В связи с этим оно легко подвергается действию разбавленных кислот, превращаясь в соль двухвалентного железа, например:
Fe + 2НСl = FeCl2 + Н2↑
С концентрированными серной и азотной кислотами железо не реагирует. Эти кислоты создают на поверхности металла такую прочную и плотную пленку окиси, что металл становится совершенно пассивным и уже не вступает в другие реакции. В то же время при непосредственном взаимодействии с такими сильными окислителями, как галогены, железо всегда проявляет степень окисления +3:
2Fe + 3Сl2 = 2FeCl3
Железо вступает в реакцию с перегретым паром; при этом из воды вытесняется водород, а раскаленное железо превращается в окисел, причем это всегда либо закись железа FeO, либо закись-окись железа
Fe3O4(Fe2O3 · FeO):
Fe + Н2О = FeO + H2↑
3Fe + 4H2O = Fe3O4 + 4H2↑
Раскаленное в чистом кислороде железо энергично сгорает с образованием железной окалины (см. рис. 40).
3Fe + 2O2 = Fe3O4
При прокаливании железо образует с углеродом сплав и одновременно карбид железа Fe3C.
- Перечислите физические свойства железа.
- Каковы химические свойства железа? Дайте обоснованный ответ. (См. Ответ)
Соединения железа
Железо образует два ряда соединений — соединения Fe+2 и Fe+3. Для железа характерны два окисла — закись FeO и окись Fe2O3. Правда, известен смешанный окисел Fe3O4, молекула которого представляет собой кислородные соединения двух- и трехвалентного железа: Fe2O3 · FeO. Этот окисел называется также железной окалиной, или закисью-окисью железа.
Соединения закисного железа менее стойки, чем окисно-о, и при наличии окислителя, даже если им является только кислород воздуха, обычно переходят в соединения трехвалентного железа. Например, гидроокись железа (II) Fe(OH)2 представляет собой белое твердое вещество, но в чистом виде ее можно получить лишь тогда, когда растворы реагирующих веществ не содержат растворенного кислорода и если реакцию вести в отсутствие кислорода воздуха:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Соль, из которой получают гидроокись железа (II), конечно, не должна содержать ни малейшей примеси окисных соединений. Поскольку такие условия создать в обычной учебной лаборатории очень трудно, гидроокись железа (II) получается в виде более или менее темно-зеленого осадка студенистого вида, что свидетельствует о происходящем окислении соединений двухвалентного железа в трехвалентное. Если гидроокись железа (II) держать длительное время на воздухе, то постепенно происходит превращение ее в гидроокись железа (III) Fe(OH)3:
4Fe(OH)2 + О2 + 2Н2O = 4Fe(OH)3
Гидроокиси железа являются типичными нерастворимыми гидроокисями. Гидроокись железа (II) обладает основными свойствами, а у гидроокиси Fe(OH)3 весьма слабо выражены амфотерные свойства.
- Перечислите свойства окиси железа как типичного основного окисла. Дайте обоснованный ответ. Все уравнения реакций напишите в полной и сокращенной ионных формах. (См. Ответ)
- Перечислите свойства гидроокиси железа (II). Подтвердите свой ответ уравнениями реакций. (См. Ответ)
Значение солей
Среди солей железа (II) наибольшее значение имеет железный купорос FeSO4 · 7H2O, в состав которого входит 7 молекул кристаллизационной воды. Железный купорос хорошо растворяется в воде. Применяется он для борьбы с вредителями сельского хозяйства, а также при изготовлении красителей.
Из солей трехвалентного железа наибольшее значение имеет хлорид железа FeCl3, представляющий собой весьма гигроскопичные оранжевые кристаллы, которые при хранении поглощают воду и расплываются в коричневую кашицу.
Соли железа (II) легко могут переходить в соли железа (III), например при нагревании с азотной кислотой или с перманганатом калия в присутствии серной кислоты:
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4Н2O
Окисление солей Fe+2 в соли Fe+3 может происходить и под действием кислорода воздуха при хранении этих соединений, но только этот процесс более длительный. Для распознавания катионов Fe2+ и Fe3+ служат очень характерные специфические реактивы. Например, для распознавания двухвалентного железа берут красную кровяную соль K3[Fe(CN)6], которая при наличии ионов двухвалентного железа дает с ними характерный интенсивный синий осадок турнбулевой сини:
3FeSО4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3K2SО4
или в ионном виде
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2
Для распознавания солей Fe3+ применяют реакцию с желтой кровяной солью K4[Fe(CN)6]:
4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3
При этом выпадает интенсивного синего цвета осадок берлинской лазури. Берлинская лазурь и турнбулева синь используются в качестве красителей.
Кроме того, трехвалентное железо можно распознавать с помощью растворимых солей — роданида калия KCNS или роданида аммония NH4CNS. При взаимодействии этих веществ с солями Fe(III) раствор приобретает кроваво-красную окраску.
- Перечислите свойства солей Fe+3 и Fe+2. Какая степень окисления является более устойчивой?
- Как осуществить превращение соли Fe+2 в соль Fe+3 и наоборот? Приведите примеры. (См. Ответ)
Реакция идет по уравнению:
FeCl3 + 3KCNS = Fe(CNS)3 + 3КСl
или в ионном виде
Fe3+ + 3CNS— = Fe(CNS),
В чем железо
Соединения железа играют большую роль в жизни организмов. Например, оно входит в состав главного белка крови — гемоглобина, а также зеленого вещества растений — хлорофилла. Железо поступает в организм главным образом в составе органических веществ пищевых продуктов.
Много железа содержат яблоки, яйца, шпинат, свекла. В качестве лекарственных препаратов железо применяется в виде солей органических кислот. Хлорид железа служит кровоостанавливающим средством.
- В трех пробирках находятся: а) сульфат железа (II), б) сульфат железа (III) и в) хлорид железа (III). Как определить, в какой пробирке какая соль?
- Как осуществить ряд превращений:Fe → FeCl2 → FeSO4 → Fe2(SO4)3 → Fe(OH)3 → Fe2O3.
- Даны следующие вещества: железо, соляная кислота, хлор, едкий натр. Как, пользуясь только этими веществами, получить гидроокись железа (II) и гидроокись железа (III)?
- Раствор, содержащий хлорид хрома (III) и хлорид железа (III), обработали избытком щелочи. Полученный осадок отфильтровали. Что осталось на фильтре и что перешло в фильтрат? Дайте обоснованный ответ при помощи уравнений реакций в молекулярной, полной ионной и сокращенной ионной формах. (См. Ответ)
Сплавы железа
Железо является основой черной металлургии, поэтому его добывают в огромных количествах. Новая программа развернутого строительства коммунизма предусматривает в 1980 г. производство 250 млн. т стали. Это в 3,8 раза больше, чем в 1960 г.
Железо почти никогда не применяется в чистом виде, а только в виде сплавов. Важнейшими сплавами железа являются его сплавы с углеродом — различные чугуны и стали. Основное отличие чугуна от стали в содержании углерода: в чугуне содержится более 1,7% углерода, а в стали — менее 1,7%.
Большое практическое значение имеют ферросплавы (сплав железа с кремнием), феррохром (сплав железа с хромом), ферромарганец (сплав железа с марганцем). Ферросплавы — это чугуны, содержащие более 10% железа и не менее 10% соответствующего компонента. Кроме того, в них имеются те же самые элементы, что и в чугуне. Ферросплавы применяются в основном при «раскислении» стали и как легирующие примеси.
Среди чугунов различают линейные и передельные. Литейный чугун используется для отливок различных деталей, передельный—переплавляется на сталь, так как обладает очень высокой твердостью и не поддается обработке. Передельный чугун белого цвета, а литейный — серого. Передельный чугун содержит больше марганца.
Стали бывают углеродистые и легированные. Углеродистые стали обычно представляют собой сплав железа с углеродом, а легированные содержат легирующие добавки, т. е. примеси других металлов, придающие стали более ценные свойства. Ванадий придает стали ковкость, упругость, устойчивость при закалке, вольфрам и молибден — твердость и жаропрочность.
Стали с добавками циркония очень упруги и пластичны; их используют для изготовления броневых плит. Примеси марганца делают сталь устойчивой к удару и трению. Бор повышает режущие свойства стали при изготовлении инструментальных сталей.
Иногда даже незначительные примеси редких металлов придают стали новые свойства. Если выдержать стальную деталь в порошке бериллия при температуре 900—1000°, то твердость стали, ее износоустойчивость сильно повышаются.
Хромоникелевые или, как их еще называют, нержавеющие, стали устойчивы к коррозии. Сильно вредят стали примеси серы и фосфора — они делают металл хрупким.
- Какие важнейшие сплавы железа вам известны? (См. Ответ)
- В чем главное отличие стали от чугуна?
- Какие свойства чугуна и какие виды чугуна вы знаете?
- Что такое легированные стали и легирующие добавки? (См. Ответ)
Доменный процесс
Чугун получается путем восстановительной плавки в доменных печах. Это огромные сооружения тридцатиметровой высоты, выдающие в сутки более 2000 т чугуна. Схема устройства доменной печи приведена на рис. 83.
Верхняя часть домны, через которую загружается шихта, называется колошником. Через колошник шихта
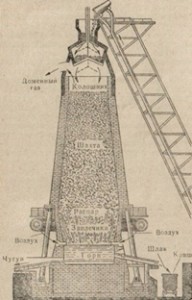
попадает в длинную шахту печи, расширяющуюся книзу, что облегчает передвижение загружаемого материала сверху вниз. По мере передвижения шихты к наиболее широкой части печи — распару — с ней происходит ряд превращений, в результате которых образуется чугун, стекающий в горн — наиболее горячую часть печи.
Здесь же собирается шлак. Чугун и шлак выпускают из печи через специальные отверстия в горне, называемые летками. Через верхнюю часть горна в домну вдувают воздух, поддерживающий горение топлива в печи.
Рассмотрим химические процессы, протекающие при выплавке чугуна. Шихта доменной печи, т. е. комплекс загружаемых в нее веществ, состоит из железной руды, топлива и флюсов, или плавней. Железных руд имеется много. Главные руды — магнитный железняк Fe3О4, красный железняк Fe2О3, бурый железняк 2Fe2О8 · 3H2О.
В доменном процессе в качестве железной руды применяется сидерит FeCO3, а иногда пирит FeS2, превращающийся после обжига в колчеданных печах в огарок Fe2О3, который и может использоваться в металлургии. Такая руда менее желательна из-за большой примеси серы. Выплавляют в доменной печи не только чугун, но и ферросплавы.
Топливо, загружаемое в печь, служит одновременно для поддержания высокой температуры в печи и для восстановления железа из руды, а также принимает участие в образовании сплава с углеродом. Топливом служит обычно кокс.
В процессе выплавки чугуна кокс газифицируется, превращаясь, как и в газогенераторе, сначала в двуокись а затем в окись углерода:
С + О2 = СО3
СО2 + С = 2СО
Образующаяся окись углерода является хорошим газообразным восстановителем. С ее помощью происходит восстановление железной руды:
Fe2О3 + 3СО = 3СО2 + 2Fe
Вместе с рудой, содержащей железо, в печь обязательно попадают примеси пустой породы. Они бывают весьма тугоплавки и могут закупорить печь, которая работает непрерывно долгие годы. Для того чтобы пустую породу было легко извлечь из печи, ее переводят в легкоплавкое соединение, превращая флюсами (плавнями) в шлак. Для перевода в шлак основной породы, содержащей, например, известняк, который разлагается в печи по уравнению
СаСО3 = СаО + СО2
добавляют песок. Сплавляясь с окисью кальция, песок образует силикат:
СаО + SiO3 = CaSiO3
Это вещество с несравненно более низкой температурой плавления. В жидком состоянии оно может быть выпущено из печи.
Если же порода кислая, содержащая большое количество двуокиси кремния, то тогда в печь загружается, наоборот, известняк, который переводит двуокись кремния в силикат, и в результате получается такой же шлак. Раньше шлак являлся отходом, а теперь его охлаждают водой и используют как строительный материал.
Для поддержания горения топлива в домну непрерывно подается подогретый, обогащенный кислородом воздух. Подогревается он в специальных воздухонагревателях — киуперах. Каупер — высокая башня, сложенная из огнеупорного кирпича, куда отводят отходящие из домны горячие газы. Доменные газы содержат двуокись углерода СО2, азот N2 и окись углерода СО. Окись углерода сгорает в каупере, тем самым повышая его температуру.
Затем доменные газы автоматически направляются в другой каупер, а через первый начинается продувка воздуха, направляемого в домну. В раскаленном каупере воздух нагревается, и таким образом экономится топливо, которое в большом количестве расходовалось бы на подогрев поступающего в домну воздуха. Каждая домна имеет несколько кауперов.
- Каков состав-шихты доменной печи? (См. Ответ)
- Перечислите основные химические процессы, протекающие при выплавке чугуна.
- Каков состав доменного газа и как он используется в кауперах?
- Сколько чугуна, содержащего 4% углерода, можно получить из 519, 1 кг магнитного железняка, содержащего 10% примесей?
- Какое количество кокса дает объем окиси углерода, достаточный для восстановления 320 кг окиси железа, если кокс содержит 97% чистого углерода?
- Как следует обработать сидерит и пирит, чтобы из них можно было получить железо? (См. Ответ)
Выплавка стали
Сталь выплавляется в трех видах печей — в мартеновских регенеративных печах, бессемеровских конвертерах и электропечах.
Мартеновская печь — наиболее современная печь, предназначенная для выплавки главной массы стали (рис. 84). Мартеновская печь в отличие от доменной не является непрерывно действующей печью.

Главная часть ее — это ванна, куда через окна специальной машиной загружают необходимые материалы. Ванна специальными ходами соединена с регенераторами, которые служат для нагрева горючих газов и воздуха, подающихся в печь.
Нагревание же происходит за счет тепла продуктов горения, которые время от времени пропускают через регенераторы. Поскольку их несколько, то работают они по очереди и по очереди нагреваются. Мартеновская печь может выдавать до 500 т стали за одну плавку.
Шихта мартеновской печи весьма разнообразна: в состав шихты входят чугун, металлолом, руда, флюсы (плавни) такого же характера, как и в доменном процессе. Как и в доменном процессе, при выплавке стали осуществляется подогрев воздуха и горючих газов в регенераторах за счет тепла отходящих газов. Топливом в мартеновских печах является либо мазут, распыляемый форсунками, либо горючие газы, которые в настоящее время применяются особенно широко. Топливо здесь служит только для поддержания высокой температуры в печи.
Процесс выплавки стали принципиально отличается от доменного процесса, так как доменный процесс — процесс восстановительный, а выплавка стали —процесс окислительный, цель которого понизить содержание углерода путем его окисления в массе металла. Процессы, протекающие при этом, довольно сложные.
Кислород, содержащийся в руде и поступающий с воздухом в печь для сжигания газообразного топлива, окисляет углерод, а также значительное количество железа, превращая его в основном в окись железа (II):
2Fe + О2 = 2FeO
Содержащиеся в чугуне марганец, кремний или какие-либо примеси других металлов при высокой температуре восстанавливают полученную окись железа (II) снова до металлического железа согласно уравнению:
Si + 2FeO = SiO2 + 2FeМn + FeO = МnО + Fe
Аналогично реагирует с окисью железа (II) и углерод:
С + FeO = Fe + СО
В конце процесса для восстановления оставшейся окиси железа (II) (или, как говорят, для «раскисления» ее) добавляют «раскислители»— ферросплавы. Имеющиеся в них добавки марганца, кремния восстанавливают оставшуюся окись железа (II) по указанным выше уравнениям. После этого плавка заканчивается. Плавка в мартеновских печах ведется 8—10 часов.
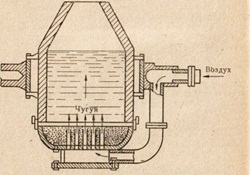
Бессемеровский конвертор (рис. 85) — печь более старого образца, но с очень высокой производительностью. Так как конвертор работает без затрат топлива, то этот способ производства стали занимает значительное место в металлургии. Конвертор — грушевидный стальной сосуд емкостью 20—30 т, футерованный изнутри огнеупорным кирпичом.
Каждая плавка в конверторе продолжается 12—15 минут. Конвертор имеет ряд недостатков: он может работать только на жидком чугуне. Это связано с тем, что окисление углерода ведется воздухом, пропускаемым снизу через всю массу жидкого чугуна, что значительно ускоряет плавку и усиливает интенсивность окисления.
Естественно, что «угар» железа в этом случае особенно велик. В то же время короткий срок плавки не позволяет регулировать ее, добавлять легирующие примеси, поэтому в конверторах выплавляют главным образом углеродистые стали. В конце плавки подачу воздуха прекращают и, как и в мартеновском процессе, добавляют «раскислители».
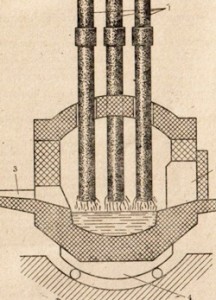
В электропечах (рис. 86) выплавляется легированная сталь специальных сортов, главным образом с высок и температурой плавления, содержащая кобальт, хром, вольфрам и другие добавки. Готовую сталь направляют в прокатку. Там на огромных прокатных станах — блюмингах и слябингах — обжимают раскаленные стальные болванки с помощью валков, позволяющих изготовлять из стального слитка разнообразные формы.
Железо в виде сплавов находит широкое применение в народном хозяйстве. Без него не обходится ни одна отрасль народного хозяйства. В целях экономии черных металлов в настоящее время по мере возможности стараются заменять их синтетическими материалами.
Из черных металлов изготовляют станки и автомобили, самолеты и инструменты, арматуру для железобетонных конструкций, жесть для консервных коробок и кровельное листовое железо, корабли и мосты, сельскохозяйственные машины и балки , трубы и целый ряд бытовых изделий.
- В чем принципиальное отличие процесса выплавки стали от доменного процесса?
- Какие печи служат для выплавки стали ? (См. Ответ)
- Что такое регенераторы в мартеновской печи ?
- Укажите состав шихты мартеновской печи и его отличие от состава шихты доменной печи?
- Что такое «раскислители»?
- Почему выплавку стали называют окислительной плавкой?
- Сколько стали, содержащей 1% углерода, можно получить из 116,7 кг чугуна, содержащего 4% углерода?
- Сколько потребуется ферромарганца, содержащего 80% марганца, чтобы «раскислить» 36 кг закиси железа? (См. Ответ)
Статья на тему Железо, побочная подгруппа VIII группы


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.