Химические реакции это переход одного или нескольких химических веществ в другие вещества, при этом ядра атомов не меняются, а происходит перераспределение ядер и электронов, в результате чего образуются новые химические соединения.
Подразделяются на: по наличию границы раздела фаз, по изменению степеней окисления реагентов, по тепловому эффекту реакции, по типу превращений реагирующих частиц, по направлению протекания, и другие.
Что такое химические реакции
Формула элементарного водорода — Н2, элементарного кислорода — О2 и воды — Н2О. Используя для обозначения молекул формулы, рис. 3-3 можно заменить следующими выражениями:
2Н2 + 1O2 → 2Н2О (2)
4Н2 + 2O2 → 4H2O (3)
2Н2О → 1O2 + 2Н2 (4)
Эти выражения называют уравнениями химических реакций. Следует отметить, что для обозначения двух молекул вещества перед его формулой ставится коэффициент 2.
Коэффициент 2 перед формулой Н2О обозначает две молекулы воды, причем он относится к каждому символу в формуле. В двух молекулах воды имеется шесть атомов — четыре атома водорода и два атома кислорода.
Отметим также, что уравнение (3) получено из уравнения (2) просто удвоением всех коэффициентов. Уравнение (4) является обратным по отношению к уравнению (2): уравнение (2) выражает образование воды из элементов, а уравнение (4) — разложение воды.
Во всех уравнениях предполагается, что число атомов сохраняется. Числа всех атомов, полученные умножением на индекс у символа и на коэффициент перед ним и суммированием, в левой и правой частях уравнения должны быть равны.
Уравнение реакция для горения метана
Природный газ состоит в основном из метана, имеющего формулу СН4. Горение метана происходит согласно следующему уравнению:
1СН4 + 2О2 → 1СО2 + 2Н2О (5)
Число атомов реагирующих веществ равно числу атомов продуктов реакции. В каждой части уравнения имеются один атом углерода, четыре атома водорода и четыре атома кислорода.
Поскольку между понятием «молекула» и «моль» существует определенное соотношение, уравнение (5) можно прочитать двояко:
- «одна молекула метана реагирует с двумя молекулами кислорода, образуя одну молекулу двуокиси углерода и двемолекулы воды», или
- «1 моль метана реагирует с 2 молями кислорода, образуя 1 моль двуокиси углерода и 2 моля воды».
Запись уравнений реакций
Как можно записать уравнение реакции без предварительного ее изображения? Напомним, что для этого вам необходимо знать:
- Что реагирующие вещества расходуются и при этом образуются продукты реакции;
- Точные формулы всех реагирующих веществ и продуктов реакции;
- Что соблюдается закон сохранения атомов.
Рассмотрим реакцию горения магния с образованием окиси магния. Металлический магний и окись магния — твердые вещества. Они имеют формулы Mg и MgO соответственно.
Сначала напишем формулы реагирующих веществ в левой части уравнения и формулы продуктов реакции в правой части
Mg + О2 → MgO
Но в этом выражении не соблюдается закон сохранения атомов. Нам надо найти числовые коэффициенты для каждой формулы, чтобы число атомов всех элементов в левой части уравнения было равно числу атомов этих же элементов в правой части.
Процесс подбора коэффициентов называется уравниванием обеих частей уравнения. Уравнять простые реакции легко.
Сначала мы можем предположить, что в рассматриваемой реакции участвует 1 моль кислорода:
Mg + 1О2 → MgO
Но так как 1 моль кислорода О2 содержит 2 моля атомов кислорода, при реакции должно образоваться 2 моля окиси магния:
Mg + 1 О2 → 2MgO
Для образования 2 молей окиси магния требуется 2 моля металлического магния. Таким образом,
2Mg + 1 О2 → 2MgO (6)
Уравнение (6) является химическим уравнением. Поскольку число атомов в уравнении сохраняется, говорят, что оно уравнено.
Мы можем также начать уравнивание, предположив, что в реакции принимает участие 1 моль металлического магния:
lMg + О2 → MgO
1 моль магния содержит 1 моль атомов металла; следовательно, при реакции образуется 1 моль окиси магния:
lMg + О2 → lMgO
1 моль окись магния содержит 1 моль атомов кислорода, т. е. столько же, сколько их содержится в 1/2 моля молекул кислорода. Таким образом,
1Mg + 1/2О2 → MgO (7)
Уравнение (7) является тоже химическим уравнением, так как и в этом случае соблюдается закон сохранения атомов. Оно так же правильно выражает процесс горения магния, как и уравнение (6).
Это легко проверить, умножив коэффициенты уравнения (7) на 2. В результате мы получим уравнение (6).
Вообще в любом уравнении все коэффициенты в обеих частях уравнения можно умножать или делить на одно и тоже число; при этом получаются одинаково правильные уравнения.
В уравнениях (6) и (7) коэффициент 1 можно опустить, но можно и оставить. Это не будет ошибкой.
Химические уравнения примеры
Водород Н2 и хлор Сl2 реагируют с образованием хлористого водорода НСl. В этом процессе реагирующими веществами являются Н2 и Сl2 а продуктом реакции — НСl:
1Н2 + Cl2 →НСl
Если исходить из 1 моля Н2, то по закону сохранения атомов в результате реакции должно образоваться 2 моля НСl:
1Н2 + С2 → 2HCl
Теперь продукт реакции (2НСl) содержит 2 моля атомов хлора. Это точно соответствует числу атомов в 1 моле хлора. Реакция уравнена. Мы можем записать
1Н2 + 1Сl2, → 2HCl (8)
или
Н2 + Cl2 → 2HCl Н2 + Сl2 = 2HCl
Упражнение
Парафиновая свеча горит на воздухе с образованием воды и двуокиси углерода. Парафин состоит из молекул различной величины. Мы будем пользоваться молекулярной формулой С25Н52. 1 моль вещества свечи содержит авогадрово число этих молекул.
Формулы реагирующих веществ Формулы продуктов реакции
С25Н52 + О2 → Н2О + СО2
Предположим, что сгорел 1 моль (353 г) парафина. Используя тот же метод, что и в предыдущем примере, мы получим
1С25Н52 + О2→ 26Н2O + 25СО2
Остается определить коэффициент при О2. Поскольку продукты реакции содержат 26+(2•25) = 76 атомов кислорода, реагирующие вещества должны содержать столько же этих атомов. Покажите, что у должен быть равен 38:
С25Н52 + 38O2 → 26Н2O + 25СО2 (11)
Обычно уравнения реакций лучше выражать в молях, так как моль удобен для взвешивания. В уравнении (6) 2 моля магния весят 48,6 г, 1 моль кислорода — 32,0 г, 2 моля MgO — 80,6 г. Масса остается постоянной:
48,6 г + 32,0 г = 80,6 г
В уравнении (11) 38O2 обычно читают как 38 молей, а не 38 молекул. Выражение «38 молей газообразного кислорода» имеет реальный смысл; они весят 32 г•38 = 1216 г.
Расчеты на основе химических уравнений
По уравнению химической реакции можно вычислить веса как реагирующих веществ, так и продуктов реакции. Предположим, мы хотим знать, сколько молей воды образуется при сгорании 68 г аммиака. Горение аммиака происходит по уравнению реакции
2NH3 + 3/2 О2 →1N2 + 3Н2О (9)
1 моль аммиака весит 17 г. Из 2 молей аммиака, которые весят 34 г, образуется 3 моля воды. Мы хотим ввести в эту реакцию 68 г аммиака. Сколько это составляет молей?
68г/17(г/моль)= 4,0 моля
Следовательно, мы можем записать:
2NH3 + 3/2o2 → N2 + 3Н2О 2 моля аммиака дают 3 моля воды
4 моля аммиака дают 6 молей воды
Мы нашли, что из, 68 г (4 молей) аммиака по реакции (9) образуется 6 молей воды.
Образование воды из водорода и кислорода
Что для получения 100 молекул воды расходуется 100 молекул водорода и 50 молекул кислорода. Таким образом, для получения 1 моля воды (6,02•1083 молекул) вам потребуется 1 моль водорода (6,02-10м молекул) и 0,5 моля кислорода (3,01 •1023 молекул). Результаты приведены в табл..
Количества водорода и кислорода прореагировавшие с образованием воды
| Водород | Кислород | Вода | |
| а) Число молекул | 2 | 1 | 2 |
| 4 | 2 | 4 | |
| 100 | 50 | 100 | |
| 6,02 • 1023 | 3,01 • 1023 | 6,02 • 1023 | |
| б) Число молей | 1 | 0,5 | 1 |
| 2 | 1 | 2 | |
| 10 | 5 | 10 |
Реакция между водородом и кислородом протекает намного быстрее, если эти газы смешать и затем поджечь смесь искрой. Происходит сильный взрыв.
Тем не менее на 1 моль реагирующего водорода образуется такое же количество продукта реакции — воды — и выделяется столько же тепла, как и при обычном горении.
Если реагируют 1 моль чистого водорода и 0,5 моля чистого кислорода, образуется 1 моль воды. Количество тепла, выделяющееся при образовании 1 моля воды, равно 68 000 кал.
Если же мы возьмем только 0,025 моля чистого водорода, то потребуется 0,5-0,025 моля кислорода. При этом образуется 0,025 моля воды. Если получено только 0,025 моля воды, то выделяется лишь 0,025-68 000 = 1700 кал тепла.
Источником этой тепловой энергии должны быть сами реагирующие вещества (водород и кислород), так как к системе извне подводится только тепло, необходимое для поджигания смеси. Отсюда можно сделать вывод, что вода содержит меньше энергии, чем реагирующие вещества, используемые для ее получения.
Реакция, при которой выделяется тепло, называется экзотермической. Количество тепла, выделяющееся при сгорании 1 моля водорода (68 000 кал, или 68 ккал), называется молярной теплотой сгорания водорода.
Разложение воды
Пропуская электрический ток через водный раствор серной кислоты в приборе. В этом приборе в жидкость погружены два проводника, называемых электродами.
Когда электроды связаны с источником электрической энергии, то на одном из них выделяется газообразный водород, а на другом — газообразный кислород. При разложении в приборе 1 моля воды на электродах образуются 1 моль водорода и 0,5 моля кислорода.
Для того чтобы происходило разложение воды, необходимо затратить определенное количество энергии (в данном случае электрической). Если при реакции происходит поглощение тепла, то реакция называется эндотермической.
Теперь мы можем сравнить две реакции — образование и разложение воды. Как показано на рис. 3-3, реакция, приводящая к образованию воды, противоположна реакции разложения воды.
Эти химические превращения подчиняются простым правилам. В левой части рисунка мы видим два атома кислорода — справа также находятся два атома кислорода. Слева мы видим четыре атома водорода — столько же атомов водорода имеется в правой части рисунка.
Мы видим, что атомы не исчезают и не появляются. При химических реакциях число атомов остается постоянным.
Число молекул Н2, необходимое для реакции с одной молекулой О2, является в то же время числом, необходимым для получения двух молекул Н2О.
Если образуются две молекулы Н2О, то расходуется четыре атома водорода. Четыре атома водорода содержатся в двух молекулах Н2. Запомните, что при химических реакциях число атомов остается постоянным.
Сохранение массы
Утверждение, что число атомов при химических реакциях остается постоянным, основано на общем правиле, которое выдержало испытание временем.
Материя не может создаваться или исчезать. Поскольку мы часто выражаем количество материи через ее массу (например, взвешиванием), можно сказать, что масса при химических реакциях сохраняется.
Так, 1 моль воды весит 18,0 г; при разложении 1 моля воды образуются 2,0 г водорода и 16,0 г кислорода:
1 моль воды → 1 моль водорода + 1/2 моля кислорода (l) Н2О Н, 1/2 О2
18,0 г → 2,0 г + 16,0 г
18,0 г → 18,0 г
Масса 1 моля воды складывается из массы атомов, которые содержатся в нем, поэтому сохранение массы предполагает и сохранение атомов.
Вопросы и задачи для самостоятельной работы
1. 1 объем водорода реагирует с 1 объемом хлора с образованием 2 объемов хлористого водорода. Экспериментально установлено, что молекулярная формула водорода — Н2, хлора — Сl2 и хлористого водорода — HCl. Реакция записывается так:
Н2 + Cl2 → 2HCl
В соответствии с этим уравнением определите:
а) Сколько молекул НСl образуется из одной молекулы Н2?
б) Сколько молей НСl образуется из 1 моля Н2?
в) Сколько молекул НСl образуется из четырех молекул Сl2?
г) Из скольких молей Сl2 образуется 8 молей НСl?
2. Реакция между окисью азота NO и кислородом O2 записывается так:
2NO + O → 2NO2
а) Сколько молекул NO2 образуется из двух молекул NO?
б) Сколько молей NО2 образуется из 2 молей NO?
в) Сколько молей атомов кислорода содержится в 2 молях NO?
В 1 моле O2? В 2 молях NO2?
На основании ответов на вопрос (в) покажите, что в записанном уравнении реакции соблюдается требование сохранения числа атомов кислорода.
3. а) Напишите уравнение реакции между азотом и водородом с образованием аммиака, принимая, что молекулярная формула азота — N2, водорода — Н2 и аммиака — NH3. б) Покажите, что в записанном уравнении реакции соблюдается требование сохранения числа атомов азота и водорода.
4. При разложении аммиака на азот и водород поглощается определенное количество тепла. Реакция записывается так:
2NH3 + 22 ккал → N2 + 3Н2
а) Сколько молей N2 образуется из 2 молей NH3?
б) Какое количество тепла поглощается при образовании 1 моля N2?
в) Какое количество тепла поглощается при образовании 9 молей Н2?
г) Вычислите вес 2 молей NH3 и сравните его с суммой весов 1 моля N2 и 3 молей Н2.

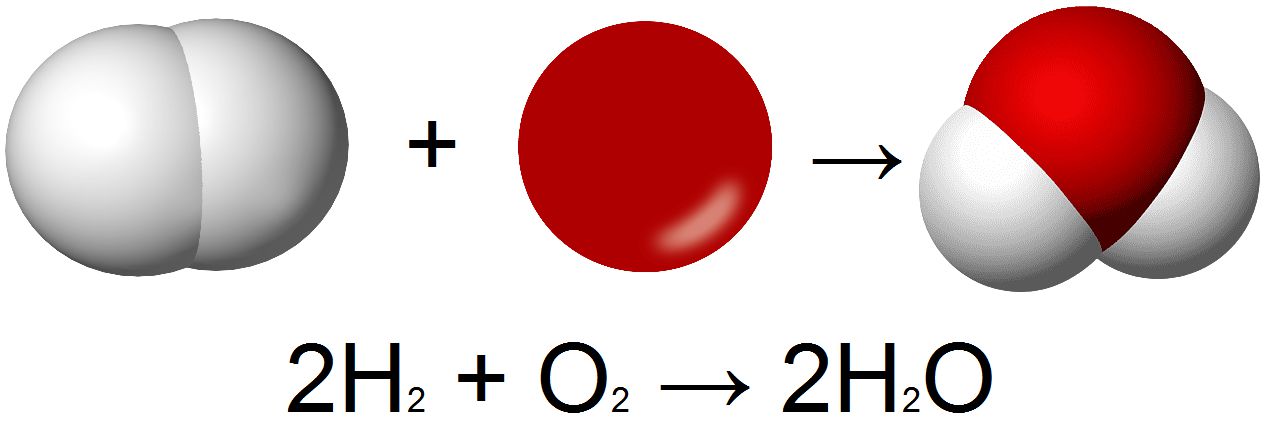
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.