Нитрит ион это неорганическое соединение, состоящее из азота и кислорода. Химическая формула нитрит-иона NO2—.
В пищевой промышленности нитрит натрия обычно используется в качестве отвердителя. Нитрит или нитрат натрия отвечает за цвет и вкус приготовленного вяленого мяса.
В природе нитрит-анион является распространенным посредником в азотном цикле. Нитрит также относится к химическим молекулам, содержащим группу — ОNО, которые представляют собой сложные эфиры азотистой кислоты.
Что такое нитрит
Элементами, которые входят в формулу нитрита, являются азот и кислород. Для написания его формулы требуется четкое представление о валентностях как азота, так и кислорода.
Как известно, символом нитрита является NO2—. Нитрит-ион имеет симметричную структуру (симметрия C2v), с равной длиной связей N–O и углом связи примерно 115 градусов.
Он описывается как резонансный гибрид в теории валентных связей, с равным вкладом двух канонических форм, которые являются зеркальными отражениями друг друга.
В теории молекулярных орбиталей существует сигма-связь между каждым атомом кислорода и атомом азота, а также делокализованная связь, генерируемая из p-орбиталей на атомах азота и кислорода, которая перпендикулярна плоскости молекулы.
Отрицательный заряд иона равномерно распределяется между двумя атомами кислорода. Одинокая пара электронов переносится атомами азота и кислорода. Таким образом, нитрит-ион является основанием Льюиса.
Консервант нитрит натрия защищает ветчину, салями и другое обработанное и вяленое мясо от опасных микроорганизмов, а также придает им розовый оттенок.
Однако нитрит может повредить клетки и превратиться в канцерогенные химические вещества в организме человека в определенных ситуациях.
Свойства нитрита
- Кислотно-основные свойства нитрит-иона
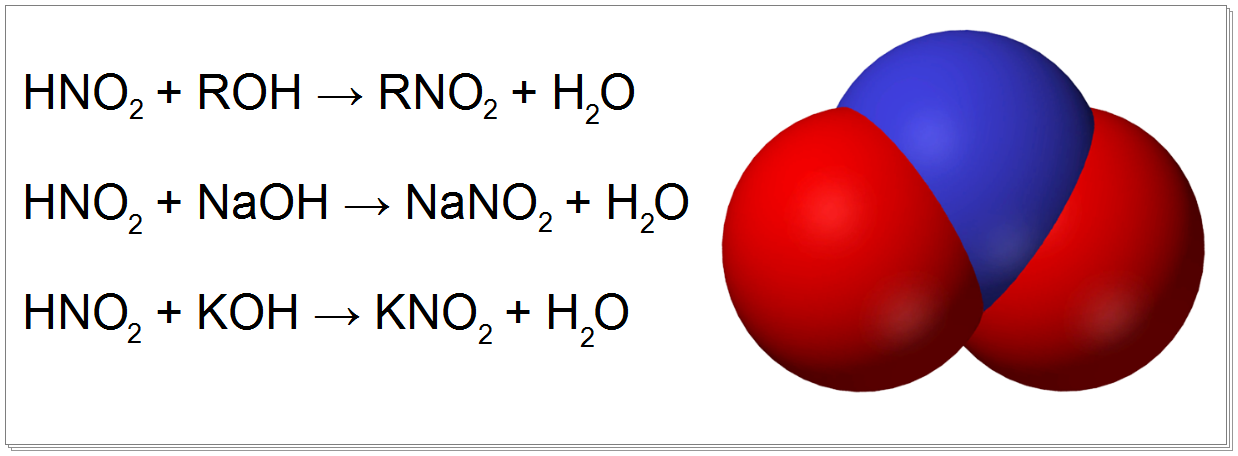
Конъюгатным основанием слабокислой азотистой кислоты является нитрит:
HNO2 ⇌ H+ + NO2—; pKa ≈ 3.3 при 18 °C
- Азотистая кислота также чрезвычайно летуча, в основном существует в виде транс-плоской молекулы в газовой фазе. он нестабилен в растворе с точки зрения реакции диспропорционирования:
3HNO2 (aq) ⇌ H3O+ + NO3— + 2NO
При 0 °C эта реакция протекает вяло. Получение оксида азота (NO) в лаборатории включает добавление кислоты в раствор нитрита в присутствии восстановителя, такого как железо(II).
Окисление и восстановление
Атом азота в нитрите имеет формальную степень окисления +3. Это означает, что он может быть окислен до +4 и +5 уровней окисления или снижен до уровня окисления до 3. В таблице ниже приведены стандартные восстановительные потенциалы для процессов, непосредственно связанных с азотистой кислотой: рассмотрим следующий сценарий:
H2N2O2 + 2 H+ + 2 e— ⇌ N2 + 2 H2O; E0 = +2,65 В
Когда азот находится в состоянии окисления +5, реакции окисления обычно приводят к образованию нитрат-иона.
Для количественного анализа нитритов (титрованием) можно использовать, например, окисление перманганат-ионом:
5 NO2— + 2 MnO4— + 6 H+ → 5 NO3— + 2 Mn2+ + 3 H2O
Реакции восстановления с нитрит-ионом дают различные продукты, в зависимости от восстановителя и его интенсивности.
С диоксидом серы продуктами являются NO и N2O; с оловом(II) (Sn2+)продуктом является гипонитрозная кислота (H2N2O2); а с сероводородом продуктом является аммиак (NH3).
Результатом восстановления нитрита катионом гидразиния (N2H5+) является гидразойная кислота (HN3) (азид водорода или азоимид), нестабильное и взрывчатое соединение, который также может реагировать с нитритом следующим образом:
HNO2 + HN3 → N2O + N2 + H2O
Эта реакция уникальна тем, что включает молекулы азота в четырех различных состояниях окисления.
Часто задаваемые вопросы ответы о нитрите?
Какова формула нитрита? В чем его польза?
Формула нитрит-иона NO2—. Применение нитрита приведено ниже:
Он используется в качестве противоиона в различных реакциях.
Используется в качестве консерванта.
Он используется в качестве противоядия для лечения отравления цианидом.
Является ли химическая формула нитрит-иона и молекулярная формула нитрита одинаковыми?
Да, химическая и молекулярная формула нитрита одинакова. Нитрит может вредить клеткам и превращаться в канцерогенные химические вещества в организме человека при определенных условиях.
Нитрат и нитрит могут вступать в реакцию с аминами и амидами в организме с образованием N-нитрозосоединений (NOC), которые, как было показано, вызывают рак у животных и могут вызывать рак у людей при потреблении через питьевую воду и другие источники пищи.