Спектр это совокупность простых электромагнитных волн, составляющих данное сложное излучение.
Спектр, в котором представлены все длины волн и который, следовательно, состоит из постепенно переходящих одна в другую цветных полос, называется непрерывным, или сплошным спектром.
Такие спектры излучаются раскаленными твердыми и жидкими телами, а также газами, находящимися под высоким давлением.
К этому виду относится и спектр Солнца. Сплошной спектр излучения накаленного твердого тела, полученный с помощью стеклянной призмы.
Ширина цветных полос в нем зависит от дисперсии вещества, из которого сделана призма.
Что такое спектр типы спектров
Монохроматическое излучение имеет спектр в виде одной узкой линии.
Излучение, состоящее из нескольких монохроматических волн, дает линейчатый спектр, состоящий из соответствующего числа линий.
Линейчатые спектры характерны для излучения газов и паров металлов.
Например, пары натрия имеют в видимой части спектра две близко расположенные линии желтого цвета,
пары лития — две линии: красную и оранжевую,
водород — четыре линии: красную, голубую и две фиолетовые.
В видимой части спектра паров ртути наиболее яркие линии: оранжевая, желтая, зеленая, голубая и фиолетовая.
Видимый свет это небольшая часть широкого спектра электромагнитного излучения, который включает в себя радиоволновые, микроволновые, инфракрасные, ультрафиолетовые, видимые, рентгеновские и гамма-излучения.
Длины волн, соответствующие этим линиям, указаны в таблице.
Если близко расположенные линии сливаются в более или менее широкие полосы, такой спектр называется полосатым.
Полосатые спектры имеет, например излучение азота, паров йода и др.
Спектры излучения нагретых тел или излучения при электрическом разряде в атмосфере паров и газов, называются спектрами испускания или эмиссионными.
Таблица спектров
| Вещество | Линия спектра | λ в ммк |
| Натрий (Na) | Желтая | 589,6 |
| Желтая | 589,0 | |
| Литий (Li) | Красная | 670,8 |
| Оранжевая | 610,4 | |
| Водород (Н) | Красная | 656,5 |
| Голубая | 486,3 | |
| Фиолетовая | 434,2 | |
| Фиолетовая | 410,3 | |
| Ртуть(Hg) | Красная | 623,4 |
| Оранжевая | 612,3 | |
| Желтая | 577,0 | |
| Зеленая | 546,1 | |
| Голубая | 491,6 | |
| Фиолетовая | 435,8/433,9 | |
| Фиолетовая | 407,8/404,7 |
Спектр поглощения

И тогда в сплошном спектре белого света появляются участки (линии или полосы) затемнения, характерные для данной среды.
Совокупность темных линий или полос, образующихся в сплошном спектре белого света при прохождении его сквозь данную среду называется ее спектром поглощения или абсорбционным спектром.
Более обще: спектром поглощения данной среды называется совокупность простых электромагнитных волн, поглощенных из белого света при прохождении его через данную среду.
Для получения спектра поглощения в обычном спектроскопе между источником белого света и щелью коллиматора помещается тонкая пластинка из исследуемого вещества или плоскопараллельная кювета с исследуемым раствором.
Пары или газы поглощают излучение тех же длин волн, которые они испускают (закон Кирхгофа). Такие спектры называются обращенными.
Солнце дает сплошной спектр испускания, на котором расположен ряд темных линий поглощения (линии Фраунгофера).
Сплошной спектр дает излучение центральной части Солнца (фотосферы), темные линии являются спектрами поглощения паров и газов, составляющих атмосферу Солнца.
Спектр гемоглобина
Большое значение для медицины имеет спектр гемоглобина. Спектр поглощения оксигемоглобина, соответствующий раствору в воде насыщенной кислородом крови.
В нем имеются две полосы затемнения в желтой (589—577 ммк) и зеленой (556—536 ммк) части, а также широкая полоса затемнения в сине-фиолетовой части спектра.
Для спектра восстановленного гемоглобина характерна одна полоса затемнения в желто-зеленой (596—543 ммк) части, а также менее широкая полоса в сине-фиолетовой части.
Для спектра гемоглобина, насыщенного углекислотой (карбоксигемоглобина), характерны две полосы затемнения в желто-зеленой части спектра (579—564 и 548—530 ммк).
Спектр поглощения отражает зависимость показателя поглощения данного вещества от частоты (длины волны) света.
Для газов и паров металлов под низким давлением, например, показатель поглощения имеет большую величину только при определенных частотах колебаний, которые соответствуют линиям в спектре поглощения.
Эти частоты равны или кратны частотам собственных колебаний электронов в атомах, при которых поглощение энергии световой волны усиливается за счет резонанса (резонансное поглощение).
В пределах частот (длин волн), при которых наблюдается максимальное поглощение света, происходит явление, называемое аномальной дисперсией света.
Оно заключается в том, что характер зависимости показателя преломления вещества от частоты изменяется на обратный.
Тоесть при увеличении частоты он уменьшается и в значительной степени (по обе стороны полосы поглощения дисперсия сохраняет обычный характер).
Это явление связано с тем, что частоты, обусловливающие максимальное поглощение световых волн, являются резонансными по отношению к колебаниям электронов в атомах и молекулах вещества.
А в этих условиях характер взаимодействия между электромагнитной волной и электронами отличается от обычного.
Спектральный анализ
Каждое вещество, простое или сложное, имеет характерный для него спектр. Поэтому обратно по спектру могут быть определены природа и состав вещества.
Метод определения качественного или количественного состава вещества по его спектру называется спектральным анализом.
Основное преимущество его в том, что для анализа требуется исключительно малое количество вещества.
Путем спектрального анализа может быть обнаружено присутствие вещества в количестве до 10-10 г.
Этим методом в свое время был открыт ряд редких элементов (рубидий, цезий и др.), встречающихся в природе в очень небольших количествах.
С помощью спектрального анализа было установлено, что живые организмы содержат в крайне незначительных количествах многие металлы — кобальт, хром, титан и др.
Спектральный анализ позволяет установить следы крови (судебная медицина), микропримеси металлов в консервированных продуктах (пищевая гигиена) и т. п.
При этом используются как спектры испускания, так и спектры поглощения. В первом случае вещество нагревают до высокой температуры, поэтому молекулы его распадаются на атомы и ионы.
Для исследования молекулярного состава вещества применяют абсорбционную спектроскопию, обычно при этом исследуемое вещество растворяют в воде, которая сама не дает спектра поглощения в видимой области.
С помощью абсорбционной спектроскопии, например, был установлен молекулярный состав многих витаминов, гормонов и т, п.
Цвет тел
Ощущение цвета зависит от спектра излучения, которое попадает в глаз (также и от спектральной чувствительности самого глаза).
В случае самосветящихся тел спектр излучения зависит от природы тела, условий, вызывающих излучение, и т. д.
Большая часть окружающих тел — несамосветящиеся (освещенные) тела. Они видимы только в отраженном или проходящем свете от постороннего источника.
В этом случае в глаз попадает излучение, отраженное от поверхности тела или прошедшее сквозь тело, если оно прозрачно.
Спектральный состав его зависит, во-первых, от спектра излучения, которое падает на тело, и, во-вторых, от того, какие волны из этого спектра поглощены телом и какие соответственно отражены (для непрозрачных тел) или прошли сквозь тело (для прозрачных тел).
Если тело равномерно пропускает любые волны видимого спектра, оно называется бесцветным (большинство газов, чистая вода или простое стекло в слое небольшой толщины и др.).
Если тело равномерно и полностью поглощает все волны видимого спектра, оно называется черным (например, сажа, черная материя и др.).
Тела, равномерно и полностью отражающие все волны видимого спектра при падении на них белого света, представляются глазу белыми (окись магния, меловая бумага).
Тела, имеющие промежуточную степень равномерного поглощения любых по длине волн видимого спектра, называются серыми.
Как указывалось, показатель поглощения одной и той же среды (или тела) зависит от частоты (длины волны).
Большинство тел неравномерно поглощает волны различной длины. У некоторых тел поглощение происходит избирательно, т. е. в узком интервале частоты или длины волн.
Характерная для этих случаев зависимость показателя поглощения от длины волны изображена схематически на графике рис. 2.
Кривая 1 — для черного тела, 2 — для серого тела, 3 — для тела, имеющего широкую полосу поглощения, и 4 — для тела с узкой полосой поглощения.
Почему цвета разные
Если на тело, неравномерно поглощающее волны различной длины, падает белый свет, то свет, отраженный или прошедший сквозь него, будет отличаться от белого и восприниматься глазом как цветной.
Соответствующим цветом наделяется и само тело. Таким образом, можно сказать, что цвета тел обусловлены их спектром поглощения.
Большое разнообразие пределов избирательного поглощения у различных тел обусловливает то богатство и разнообразие цветов и красок, которое наблюдается в окружающем мире.
Если падающий на непрозрачное тело свет по спектральному составу отличается от белого света, то эти тела изменяют привычный цвет, например в желто-зеленых лучах красная бумага наблюдается черной и т. п.
Прозрачные тела (стекла, пленки), пропускающие излучение только в узком спектральном интервале (например, красное стекло, пропускающие только красные и близкие к ним лучи), называются светофильтрами и широко применяются для получения достаточного для практики монохроматического света.
Спектр атомов водорода
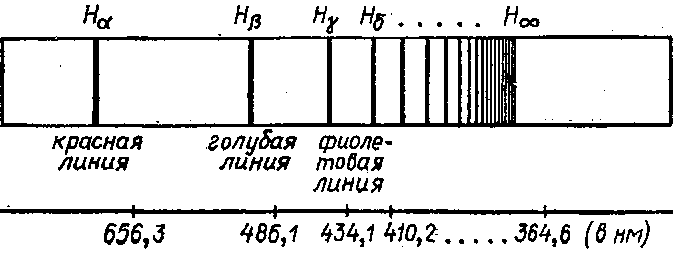
Такой спектр называется дискретным или линейчатым. Каждый химический элемент дает свой линейчатый спектр, не совпадающий со спектрами других элементов.
Спектр различных элементов отличаются цветом, положением числом отдельных светящихся линий.
Спектр атомов водорода — со стоит из небольшого числа линий (рис. 2).
В 1885 г. швейцарский учитель математики И. Бальмер вывел простое алгебраическое соотношение между длинами волн в спектре водорода:
λn = 364,56 (n2/n2 — 4) (нм)
При подстановке в эту формулу вместо n целых чисел 3, 4, 5… получаются значения к, точно совпадающие с экспериментальными.
В 1890 г. И. Ридберг показал, что формулу Бальмера можно переписать в следующем виде, где R— постоянная Ридберга, равная 1,0968 • 107м-1.
Новое уравнение ясно показывает дискретный характер спектра водорода:
волновое число vn = l/λn каждой линии представляет собой разность двух величин,
1. одна из которых — R/22 — постоянна для всех линий спектра,
2. вторая — R/n2 — зависит от номера линии n.
Дальнейшее изучение водородного спектра показало, что в его инфракрасной и ультрафиолетовой областях имеются аналогичные «серии» линий, волновые числа которых можно рассчитать с помощью уравнения Ридберга.
Только вместо числа 2 в знаменатель первого члена надо подставить либо 1, либо 3, либо 4.
Таким образом, получается, что положение любой линии в спектре водорода может быть рассчитано с помощью формулы:
1/λn = R(1/m2 — 1/n2)
где m и n — целые положительные числа и m<n.
Так может быть, излучение света атомом происходит при переходе атома из одного энергетического состояния и другое?
В 1912 г. Дж. Никольсон предположил, что образование спектров — квантовое явление, и попытался применить ядерно-планетарную модель Э. Резерфорда для объяснения наблюдаемых дискретных спектров.
Однако ему не удалось создать последовательной теории строения атома. Такая теория была разработана в 1913 г. выдающимся датским физиком Нильсом Бором.
Инфракрасное излучение
По обе стороны от видимой части спектра расположены его невидимые части: инфракрасная и ультрафиолетовая.
Наличие этих частей спектра можно установить с помощью соответствующих приборов.
Инфракрасное излучение — по его тепловому действию, например, с помощью термостолбика, ультрафиолетовое излучение — по его действию на фотопластинку или по свечению флуоресцирующего экрана.
Инфракрасное излучение соответствует волнам длиной от400 до 0,76 м/с (границы видимого спектра).
Наибольшее значение для живых организмов имеет относительно короткое инфракрасное излучение с длиной волны от нескольких микронов до границы видимого света.
Оно преимущественно содержится и в спектре Солнца.
Инфракрасное излучение не видимо (длительное действие его на глаз может вызвать вредные последствия).
Простое стекло пропускает часть излучения, граничащую с видимым светом (от 3 до 0,4 мк). Вода и водяной пар поглощают излучение, начиная с длины волны 1—1,5 мк и больше.
Излучение проходит через каменную соль и сильвин. Основное действие излучения — тепловое, однако оно вызывает и химические процессы, в частности действует на фотоэмульсию специального состава.
С его помощью возможно, например, фотографирование в темноте.
Кроме солнечного излучения, в медицине используется инфракрасное излучение от искусственных источников.
Первичное действие инфракрасного излучения на организм связано с прогреванием поверхностно лежащих тканей.
Глубина проникания в ткани инфракрасного излучения составляет несколько миллиметров.
Ультрафиолетовое излучение
Ультрафиолетовое излучение охватывает область длин волн от 380 ммк (граница видимого излучения) до 10 ммк (граница рентгеновского излучения).
Оно подразделяется на ближнее (или флюоресцентное) от 380 до 200 ммки дальнее, или вакуумное, от 200 до 10 ммк.
Ультрафиолетовое излучение поглощается простым стеклом, но при длине волны не короче 200 ммк проводит через кварц, каменную соль, плавиковый шпат и специальные стекла.
При длине волны короче 200 ммк излучение поглощается тонким слоем любого вещества, в том числе и воздуха.
Ультрафиолетовое излучение с длиной волны меньше 290 ммк интенсивно поглощается озоном.
Поэтому, вследствие поглощения в атмосфере коротковолновое ультрафиолетовое излучение Солнца, вредно влияющее на организмы, не достигает земной поверхности.
Влияние ультрафиолетового излучения на живые организмы
Ультрафиолетовое излучение невидимо, но отличается сильным действием на живые организмы и имеет большое значение для жизни растений, животных и людей.
Первичное действие его в этом случае связано с фотохимическими реакциями, возникающими при поглощении излучения.
В ткани организма ультрафиолетовое излучение проникает очень неглубоко, от 0,1 до 1 мм, однако вызывает при этом сложную биологическую реакцию, проявляющуюся на месте действия излучения эритемой.
Эритемой называется характерное интенсивное покраснение кожи, которое появляется через 6—12 ч, после действия излучения, удерживается в течение нескольких дней, затем проходит, но оставляет на длительное время светло-коричневую пигментацию кожи, называемую загаром.
В соответствии с особенностями биологического действия выделяют следующие зоны ультрафиолетового излучения: антирахитная, эритемная и бактерицидная.
Антирахитная
Зона А — антирахитная. Длина волны от 400 до 315 ммк; отличается укрепляющим и закаливающим организм действием.
Которое свойственно достигающей земли части ультрафиолетового излучения Солнца. Используется в гигиенических и профилактических целях.
Эритемная
Зона В — эритемная. Длина волны от 315 до 280 ммк; характеризуется эритемным действием, наиболее выраженным при длине волны 296,7 ммк. Используется в лечебных целях.
Бактерицидная
Зона С — бактерицидная. Длина волны от 280 до 200 ммк, отличается бактерицидным (т. е. убивающим бактерий) действием, наиболее выраженным при длине волны 253,7 ммк.
Используется в качестве средства дезинфекции.
Ультрафиолетовое излучение вызывает очень болезненное воспаление наружной оболочки глаз яблока (конъюнктивит). Поэтому, работая с источниками ультрафиолетового излучения, необходимо защищать глаза специальными очками.
Применение спектрального анализа
Атомный спектральный анализ находит широкое практическое применение по сравнению с другими методами спектрального анализа.
Он используется для исследования самых разнообразных материалов таких как металлы, сплавы, органических веществ, органические вещества в анализе металлов.
В астрономии для определения состава газов планет например определения гелия на солнце.
С помощью эмиссионной спектрометрии решаются целый ряд аналитических задач:
1. Исследование химического состава сплава при ведении плавки металла.
2. Анализ готовых изделий с целью определения марки, состава, примесей.
3. Контроль качества на всех стадиях производства.
4. Контроль качества исходного материала.
5. Экологический мониторинг состояния окружающей среды.
6. Изучение химического состава геологических объектов.
Статья на тему Спектр


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.