Теория Бора
1. Электроны могут двигаться вокруг ядра только по строго определенным (стационарным) круговым орбитам.
2. Угловой момент количества движения электрона но кругу меняется скачкообразно.
3. При движении по стационарным орбитам электрон не поглощает и не излучает энергию.
4. При переходе с одной стационарной орбиты на другую, более близкую к ядру, электрон теряет квант энергии в виде светового излучения.
Рис. Вращение электрона вокруг собственной оси
Основываясь на этих постулатах, ученый построил математическую модель атома водорода. Он получил выражения для радиусов стационарных орбит:
и для скорости движения электрона по стационарной орбите п:
Подставляя в эти формулы численные значения постоянных h, π, т и е, получаем при n=1.
r1 = 5,29•10-11 м (0,0529 нм),
υ1 = 2,19•106 м/сек (2190 км/сек)
Нетрудно показать, что
r1: r2 : r3 : … :rn = 12: 22: 32: … : n2
Полная энергия электрона равна сумме потенциальной (U) и кинетической (Т) энергий: Еполн. =U + Т
Согласно теории Бора
При переходе электрона с одной орбиты на другую его энергия изменяется на величину
∆Е = Е2—Е1
где цифpa 1 означает первоначальное состояние электрона, а цифра 2 — его конечное состояние. Если E2<E1(электрон перешёл с более удаленной на более близкую к ядру орбиту), происходит испускание фотона с энергией hν = ∆Е ; если же Е2>Е (электрон перешел на более удаленную орбиту), это означает, что электрон получил извне квант энергии hv = ∆Е. Легко вывести
Поскольку ∆Е = hν, получаем следующее выражение для частоты ν света, испускаемого или поглощаемого атомом водорода:
Сравним последнее равенство с уже известным уравнением Ридберга.
Видно, что при n1=n, n2=т и эти уравнения полностью идентичны.
Рассчитанное численное значение R с достаточной точностью совпадает с экспериментально найденной постоянной Ридберга;
Rвычисл.=1,0974 •107м-1
Rэкспер.=1,0968 •107м-1
Соответствие теоретических и экспериментальных результатов является доказательством правильности теории Бора.
Целое положительное число n полностью определяет энергию электрона в атоме, а следовательно, все параметры его движения: радиусы стационарных орбит и скорости движения по этим орбитам. Поэтому оно стало называться главным квантовым числом.
Значению n =1 отвечает орбита, двигаясь по которой электрон связан с пиром наиболее прочно. Состояние атома с наименьшей внутренней энергией называется нормальным или основным; любое другое его состояние является возбужденным.
В нормальном состоянии атом может существовать неограниченно долго, совершенно не излучая энергии; в побужденном же состоянии он существует ничтожные ноли секунды. Для атома водорода это время составляет приблизительно 10-8 сек.
Теория Бора в своем первоначальном виде не смогла объяснить многие экспериментальные данные. Оказалось, например, что спектральные линии состоят из нескольких близко расположенных линий, расщепляются в электрическом поле (эффект Штарка), расщепляются в магнитном поле (эффект Зеемана).
В 1915 г. немецкий физик Арнольд Зоммерфельд предположил, что движение электрона в атоме происходит не только по круговым, но и по эллиптическим орбитам. Форма орбиты определяется орбитальным квантовым числом ln, принимающим все целочисленные значения от нуля до n—1. Двигаясь по эллиптическим орбитам, электроны подходят близко к ядру, вследствие чего их скорость, а следовательно, и масса изменяются
Для характеристики электромагнитных свойств электрона в 1925 г. было введено магнитное квантовое число ml, принимающее любые целочисленные значения от —l до +l, включая нуль. Например, при ln = 0 магнитное квантовое число может иметь только одно значение, равное нулю; при ln = 1 —три значения: —1,0, +1; при ln= = 2— пять значений: —2, —1, 0, +1, +2.
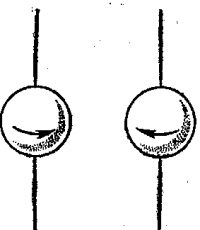
Приблизительно в это же время было высказано предположение, что электрон в атоме вращается вокруг собственной оси, и для характеристики этого движения введено спиновое квантовое число ms.
Поскольку вращение сферического тела вокруг собственной оси может происходить только в двух взаимно противоположных направлениях, спиновое квантовое число принимает одно из двух значений: +1/2 или — 1/2 (рис.).
Итак, к концу первой четверти XX в. ученые пришли к выводу о том, что состояние электрона в атоме определяется четырьмя квантовыми числами: главным n, орбитальным ln, магнитным ml и спиновым ms.Главное квантовое число п определяет общую энергию электрона.
Орбитальное квантовое число ln = f(n) характеризует форму орбиты, по которой происходит движение электрона в атоме. Магнитное квантовое число ml = f(l) определяет пространственное расположение электронных орбит, а следовательно, электромагнитные свойства электрона.
Спиновое квантовое число ms показывает, в каком из двух возможных направлений происходит вращение электрона вокруг собственной оси.
Статья на тему Теория Бора

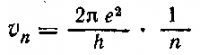
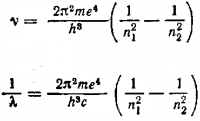
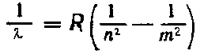
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.