Валентность химических элементов — это характеристика, определяющая способность атомов взаимодействовать с другими атомами.
Она основана на количестве электронов, которые атом может потерять, приобрести или поделиться в процессе образования химических связей.
Основные концепции валентности включают следующие аспекты:
-
Состояние электроники: Валентность часто связана с электронами, находящимися на внешнем энергетическом уровне атома. Эти электроны участвуют в образовании связей с другими атомами.
-
Типы валентности: Существуют разные типы валентности, такие как одновалентные (например, натрий), двувалентные (например, кальций) и многовалентные элементы (например, железо, которое может иметь валентность 2 или 3).
-
Влияние на химические свойства: Валентность влияет на реакционную способность элементов и их возможности образовывать сложные соединения. Например, элементы с высокой валентностью часто являются более реакционно способными и способны образовывать разнообразные химические вещества.
Валентность химических элементов
С точки зрения современных представлений валентность элемента определяется числом не спаренных электронов в его атомах.
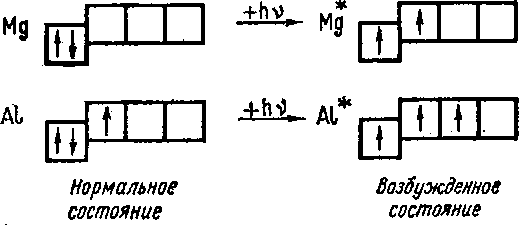
Однако если посмотреть на распределение электронов по квантовым ячейкам в атомах элементов третьего периода, то оказывается, что алюминий должен быть одновалентным металлом, а магний — нульвалентным:
Mg 1s2 2s2 p6 3s2
Al 1s2 2s2 p6 3s2 p1
Такое заключение является неправильным и вот почему.
Мы все время рассматривали распределение электронов в атомах, находящихся в нормальном, т. е. невозбужденном, состоянии.
Химические реакции обычно протекают в жестких условиях:
- На свету.
- При повышенной температуре.
- В присутствии катализаторов.
Вступающие в реакцию атомы поглощают извне энергию.
Электроны наружного квантового слоя переходят на более высокие энергетические подуровни, и общее число не спаренных электронов увеличивается.
Пример
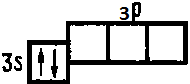
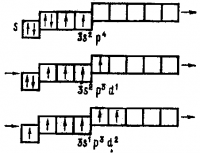
Например, в возбужденных атомах магния два не спаренных электрона, а в возбужденных атомах алюминия — три не спаренных электрона:
Энергия, затрачиваемая на возбуждение атомов, с избытком окупается за счет образования дополнительных химических связей.
На основе представления о возбужденном состоянии атомов легко объясняется наблюдаемая валентность большинства элементов (табл.).
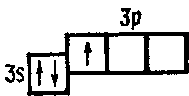
Например, атомы хлора в нормальном состоянии имеют на наружном слое один не спаренный электрон:
В соответствии с этим хлор образует такие соединения, как ClF и Сl2O, в которых он одновалентен.
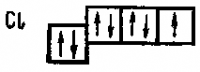
При возбуждении атомов хлора происходит последовательное заполнение свободного 3d-подуровня.
Число не спаренных электронов становится при этом равным сначала трем, затем пяти и, наконец, семи.
Таблица валентность элементов второго периода
Поэтому существуют соединения, в которых хлор трехвалентен (НСlO2), пятивалентен (КСlO3 и семи валентен (Сl2O7, НСlO4).
Последовательное возбуждение атома хлора приводит к появлению всегда нечетного числа не спаренных электронов.
Если же проследить за изменением валентного состояния атома серы, то оно оказывается всегда четным:
Статья на тему Валентность химических элементов


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.