Ar аргон (Argon; от греч. — бездеятельный) — химический элемент восемнадцатой группы с порядковым номером 18 в периодической системе.
Находится в третьем периоде. Температура плавления: -189.4 ℃. Плотность: 0.00166 г/см3. Атомная масса (молярная масса) аргона 39, 948.
В природе аргон встречается только в свободном виде.
Электронная формула
Электронная формула атома аргона:
1s2 2s2 2p6 3s2 3p6
Сокращенная электронная конфигурация Ar:
[Ne] 3s2 3p6
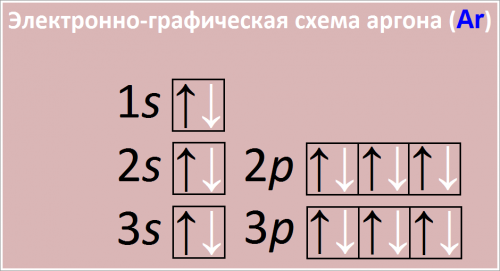
Электронно-графическая схема аргона (Ar)
Рис. Схема распределения электронов по атомным орбиталям в атоме аргона.
Энергетические уровни
Распределение электронов по энергетическим уровням в атоме Ar:
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 8
Рис. Распределение электронов по энергетическим уровням в атоме аргона Ar.
Валентные электроны аргона
Количество валентных электронов в атоме аргона — 8.
Таблица квантовых чисел аргона (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
| p | 3 | 1 | 1 | +1/2 |
| p | 3 | 1 | -1 | -1/2 |
| p | 3 | 1 | 0 | -1/2 |
| p | 3 | 1 | 1 | -1/2 |
Степень окисления аргона равна: 0.
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 36Ar | 18 | 18 | ~35.967545106 |
| 38Ar | 18 | 20 | ~37.9627324 |
| 40Ar | 18 | 22 | ~39.9623831225 |
Природный аргон состоит из стабильных изотопов 36Ar, 38Ar, 40Ar.
Искусственные радиоактивные изотопы, например 35Аr, 37Аr и 39Аr с периодами полураспада соответственно 1, 88 сек, 34 дня и 265 лет.
Никакие радиоактивные изотопы аргона не имеют никакого практического назначения.
Однако один нерадиоактивный изотоп можно использовать для определения возраста очень старых пород.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.