Теория:
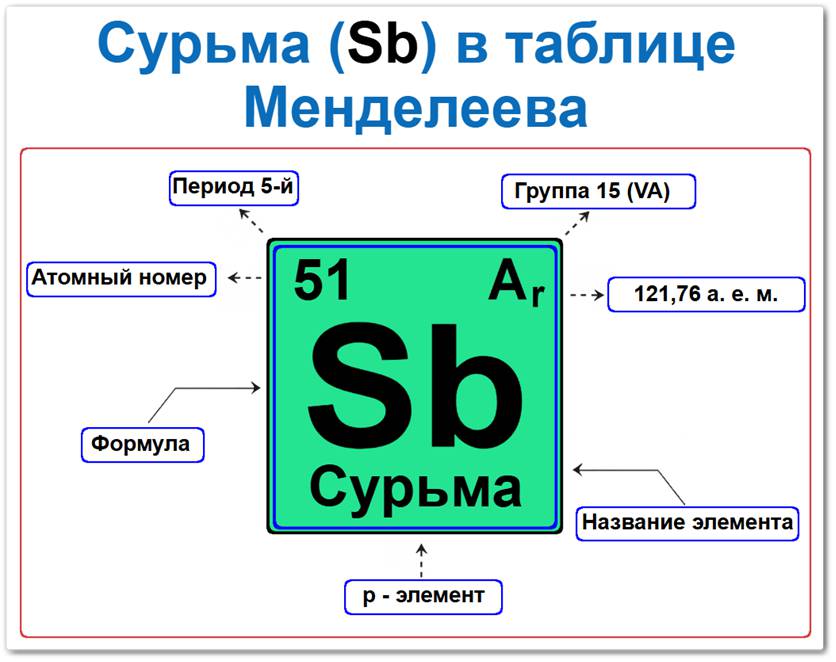
Сурьма (Sb) в периодической системе: 5‑й период, 15‑я группа (по устаревшей классификации — V A), атомная масса 121,76 а.е.м.
Занимает положение в 5‑м периоде, что определяет её принадлежность к группе полуметаллов (металлоидов) — элементов, проявляющих двойственные свойства: как металлов, так и неметаллов.
Будучи химическим аналогом мышьяка и висмута, она входит в состав p-элементов, расположенных в правой части таблицы Менделеева.
Нахождение Сурьмы в 15‑й группе (подгруппа азота) и специфическое строение внешнего электронного слоя обуславливают её ключевые параметры:
Наиболее характерные валентности III и V.
А также способность значительно увеличивать твердость сплавов (например, типографского металла) и проявлять полупроводниковые свойства в электронике.
Структура атома подтверждается её электронной формулой (конфигурацией):
[Kr] 4d10 5s2 5p3.
На которой наглядно можно определить её положение как p-блочного элемента, где происходит заполнение внешнего 5p-подуровня тремя электронами.
Сурьма в таблице Менделеева может быть определена на основании закона периодичности: положение в группе азота, период 5, группа 15 (V A), а также по её порядковому номеру (Z = 51).
Как определить положение Сурьмы в Таблице Менделеева
Локация сурьмы в таблице описывается характеристиками её атомного ядра — её «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (15-я группа, подгруппа азота).
- Период (горизонтальный ряд).
- Электронное семейство (сурьма — p‑элемент).
Порядковый номер / атомный номер (Z = 51)
- Служит уникальным кодом элемента в системе.
- В ядре — 51 протон; в нейтральной оболочке — 51 электрон.
- Электронное строение: [Kr] 4d10 5s2 5p3.
Важно: Наличие пяти электронов на внешнем уровне (5s² 5p³) позволяет сурьме образовывать соединения со степенями окисления -3, +3 и +5, что делает её важным компонентом в химическом синтезе.
Название и символ
- Название: «сурьма» (происходит от турецкого «сюрме» — чернение бровей; лат. Stibium).
- Символ: Sb.
- Примечание: Известна с глубокой древности, в природе встречается как в виде самородков, так и в составе минерала антимонита (сурьмяный блеск).
Группа (15 / V A)
Расположена в 15‑й группе. Это главная подгруппа V группы, где сурьма находится между мышьяком (As) и висмутом (Bi).
Химический потенциал:
- Валентность сурьмы: типичные валентности III и V.
- Степень окисления: от -3 до +5. Соединения сурьмы используются в производстве огнеупорных материалов (антипиренов).
Период (5‑й)
Находится в 5‑м периоде — её электроны распределены по пяти энергетическим уровням.
Влияние на свойства:
- Химическая активность: Сурьма устойчива на воздухе при комнатной температуре, но активно реагирует с галогенами.
- Физические свойства: Является хрупким серебристо-белым веществом с металлическим блеском, но плохой электропроводностью.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Sb) ≈ 121,76 а.е.м.
- Определение: среднее значение массы природных изотопов, основными из которых являются Сурьма-121 и Сурьма-123.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является 5p‑подуровень (5p3).
Специфика блока: Как p-элемент, сурьма занимает промежуточное положение между типичными металлами и неметаллами, что определяет её использование в качестве легирующей добавки в свинцовых аккумуляторах.
Определение энергетических уровней Сурьмы по Таблице Менделеева
Положение Сурьмы (Sb) в системе Менделеева — это готовый «паспорт» её внутреннего устройства.
1. 5-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Сурьмы 5 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Сурьмы — 51. Её 51 электрон распределен по уровням следующим образом:
Sb ) 2 ) 8 ) 18 ) 18 ) 5
3. 15-я группа (Химический характер)
Сурьма относится к пниктогенам (подгруппа азота).
- p-элемент: Электроны внешнего уровня определяют её склонность к ковалентным связям.
- Место в блоке: Полуметалл, проявляет амфотерные свойства (может реагировать и как кислота, и как основание).
Проверка знаний: Как определить сурьму по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Сурьму (Sb) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 51. Строгое место в системе.
- 2) 5-й период, полуметалл. Характеризует структуру и свойства.
- 3) 15-я группа. Родство с азотом, фосфором и мышьяком.
- 4) Ошибка. Сурьма — твердое вещество.
- 5) Ошибка. Сурьма находится гораздо ниже.
- 6) Ошибка. Номер 10 принадлежит Неону.
Часто задаваемые вопросы:
Сурьма расположена в 5-м периоде. Относится к 15-й группе (ранее V A подгруппа). Её порядковый номер — 51.
У сурьмы 5 энергетических уровней.
Электронная схема распределения: 2, 8, 18, 18, 5.
Сурьма является p-элементом. Её свойства определяются заполнением 5p-подуровня.