Теория:
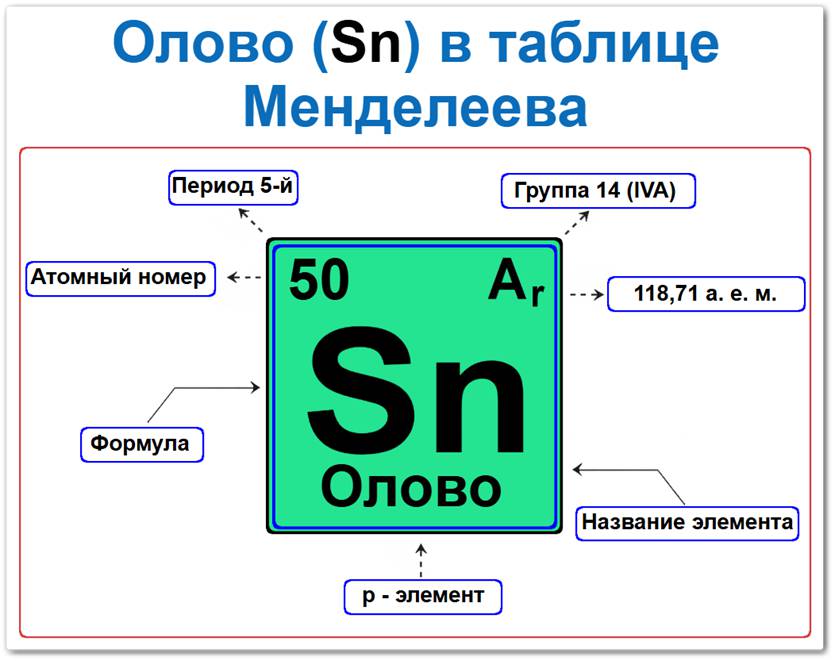
Олово (Sn) в периодической системе: 5‑й период, 14‑я группа (по устаревшей классификации — IV B), атомная масса 118,71 а.е.м.
Занимает положение в 5‑м периоде, что определяет наличие пяти энергетических уровней в его атоме.
Олово относится к группе постпереходных металлов, известных своей легкоплавкостью и способностью образовывать важные сплавы (бронза, баббит, припой).
Будучи типичным p-элементом, оно расположено в главной подгруппе четвертой группы, что обуславливает его амфотерные свойства — способность проявлять как металлические, так и неметаллические качества.
Нахождение Олова в 14‑й группе и специфическое заполнение внешнего электронного слоя обуславливают его ключевые параметры:
Наиболее характерные валентности II и IV.
А также существование в виде нескольких аллотропных модификаций: «белое олово» (металл) и «серое олово» (неметалл), переход между которыми известен как «оловянная чума».
Структура атома подтверждается его электронной формулой (конфигурацией):
[Kr] 4d10 5s2 5p2.
На которой наглядно можно определить его положение как p-блочного элемента, где происходит заполнение внешнего 5p-подуровня.
Олово в таблице Менделеева можно определить на основании закона периодичности: положение в главной подгруппе IV группы, период 5, а также по его порядковому номеру (Z = 50).
Как определить положение Олова в Таблице Менделеева
Локация олова в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (14-я группа, подгруппа углерода).
- Период (горизонтальный ряд).
- Электронное семейство (олово — p‑элемент).
Порядковый номер / атомный номер (Z = 50)
- Служит уникальным кодом элемента в системе.
- В ядре — 50 протонов; в нейтральной оболочке — 50 электронов.
- Электронное строение: [Kr] 4d10 5s2 5p2.
Важно: Наличие четырех валентных электронов (5s² 5p²) позволяет олову образовывать устойчивые соединения в степенях окисления +2 и +4.
Название и символ
- Название: «олово» (лат. Stannum).
- Символ: Sn.
- Примечание: Известно человечеству с глубокой древности как компонент бронзы; основной минерал для получения — касситерит (оловянный камень).
Группа (14 / IV B)
Расположено в 14‑й группе (ранее — главная подгруппа IV группы). В этой же группе находятся углерод, кремний и германий.
Химический потенциал:
- Валентность олова: типичные валентности II и IV.
- Степень окисления: +2, +4 (наиболее устойчива). Соединения олова широко применяются в стекольной промышленности и электронике.
Период (5‑й)
Находится в 5‑м периоде — его электроны распределены по пяти энергетическим уровням.
Влияние на свойства:
- Химическая активность: Устойчиво к воздействию воды и воздуха при обычных температурах благодаря защитной оксидной пленке.
- Антикоррозийные свойства: Широко используется для лужения (покрытия стали), например, в производстве консервных банок.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Sn) ≈ 118,71 а.е.м.
- Определение: среднее значение массы природных изотопов. Олово является «рекордсменом» — у него 10 стабильных изотопов, что больше, чем у любого другого элемента.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является 5p‑подуровнь (5p2).
Специфика блока: Как p-элемент, олово проявляет переходный характер: оно является металлом, но его оксиды и гидроксиды обладают амфотерными свойствами (реагируют и с кислотами, и со щелочами).
Определение энергетических уровней Олова по Таблице Менделеева
Положение Олова (Sn) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 5-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Олова 5 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Олова — 50. Его 50 электронов распределены по уровням следующим образом:
Sn ) 2 ) 8 ) 18 ) 18 ) 4
3. 14-я группа (Химический характер)
Олово относится к подгруппе углерода.
- p-элемент: Электронное облако застраивается на внешнем уровне.
- Металлические свойства: В отличие от вышестоящих углерода и кремния, олово — ярко выраженный металл.
Проверка знаний: Как определить олово по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Олово (Sn) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 50. Определяет заряд ядра и место в системе.
- 2) 5-й период, p-элемент. Указывает на 5 слоев и строение оболочки.
- 3) 14-я группа. Родство с углеродом и кремнием по внешним электронам.
- 4) Ошибка. Олово — очень мягкий и пластичный металл.
- 5) Ошибка. Олово находится гораздо ниже, в середине таблицы.
- 6) Ошибка. Характерные степени окисления олова +2 и +4.
Часто задаваемые вопросы:
Олово расположено в 5-м периоде, 14-й группе. Его порядковый номер — 50. Находится между германием (выше) и свинцом (ниже).
У олова 5 энергетических уровней.
Электронная схема: 2, 8, 18, 18, 4.
Олово является p-элементом. Его валентные электроны находятся на подуровнях 5s и 5p.