Электролитическое рафинирование золота и серебра
Золото и серебро занимают особое место среди металлов, выступая с давних пор в роли всеобщего эквивалента стоимости. В настоящее время серебро почти утратило эту роль и все более становится техническим металлом, находящим применение в химической промышленности (нитрат серебра), электротехнике (аккумуляторы, контакты), металлургии (свинцово-серебряные аноды).
В природе золото находится в основном в самородном (металлическом) виде.
Серебро, напротив, преимущественно встречается в виде химических соединений — минералов.
Добывается золото главным образом из руд золотоносных месторождений, а также как побочный продукт при производств других цветных металлов (меди, свинца и цинка).
Серебро добывают преимущественно не из чисто серебряных руд, а как побочный продукт при металлургической переработке полиметаллических руд (медных, цинковых и свинцово-цинковых). Такими побочными продуктами являются шламы меде электролитных заводов, цинковая пена свинцовых заводов и некоторые другие.
Золото и серебро, извлекаемые при обогатительной и металлургической переработке, содержат значительное количество различных примесей, преимущественно металлических, которые подлежат удалению.
Современное рафинирование золота и серебра («аффинаж») основано на электролитическом разделении этих металлов и примесей и во многом аналогично электролитическому рафинированию меди.
Перед электролизом золото и серебро подвергают предварительно огневому рафинированию, в ходе которого удаляется некоторая часть примесей. Эта предварительная очистка называется приемной плавкой аффинажа. Металл, прошедший приемную плавку, разливают в аноды и направляют на электролиз. В зависимости от соотношения Ag : Au в анодах их используют либо для выделения золота, либо для выделения серебра.
Электролиз серебра может проводиться в тех случаях, когда содержание золота в серебряном аноде не выше 350 проб (1000 проб соответствует 100%). Электролиз золота можно вести, если содержание серебра в золотых анодах не превышает 200 проб.. На практике, однако, стремятся всегда иметь аноды со значительно более низким содержанием второго металла. Это достигается соответствующей шихтовкой материалов, поступающих на приемную плавку.
Электролитическое рафинирование серебра
Анод из рафинируемого металла может содержать, помимо серебра, золото, медь, платину, палладий и другие платиноиды, селен, теллур, висмут, свинец и другие металлы. Содержание этих компонентов в аноде колеблется в широких пределах. Металлы, более электроположительные, чем серебро (платина, палладий, золото), при рафинировании переходят в шлам.
В раствор переходят более электроотрицательные, чем серебро, металлы, такие, как медь, железо, цинк, кадмий, никель. Из этих металлов наиболее электроотрицательные (цинк, кадмий, никель, железо) редко присутствуют в заметных количествах, так как хорошо удаляются при предшествующей переработке; медь же часто содержится в значительных количествах.
Таким образом, основными реакциями анодного растворения являются реакции растворения серебра и меди:
Ag — e → Ag+(φ°Ag|Ag+ = +0,8 в) Сu — 2е → Сu2+
Сурьма, висмут и олово, будучи более электроотрицательными, чем серебро, также растворяются анодно, однако, попав в раствор, образуют нерастворимые соединения: сурьма и висмут — гидроокиси, олово — мета-оловянную кислоту. Эти соединения являются результатом гидролиза образующихся в первый момент нитратов этих металлов. Они выпадают в шлам вместе с золотом, селеном, теллуром и платиноидами. Основная электрохимическая реакция на катоде — реакция разряда ионов серебра:
Ag++e → Ag
Содержащаяся в значительных количествах в электролите медь имеет существенно более электроотрицательный потенциал, чем серебро, и поэтому в нормальных условиях ведения процесса на катоде выделяться не может. В ходе электролиза из-за обеднения электролита в прикатодном пространстве серебром и возникновения концентрационной поляризации при большом содержании меди может начаться ее совместное выделение с серебром. Поэтому концентрация меди в растворе не должна быть выше 35—40 г/л.
Помимо указанных процессов, на катоде может происходить восстановление ионов NO-3:
2NO3— + 10Н+ + 8e → N2O+5H2O NO3— + 4H+ + 3e → NO + 2H2O NO3 + 2H++ e → NO2 + H2O
Наличие этих реакций снижает катодный выход по току, отравляет атмосферу окислами азота и уменьшает содержание в электролите азотной кислоты, убыль которой приходится компенсировать. Реакции восстановления ионов NO3— ускоряются при увеличении кислотности, но и при обычном составе электролита они протекают достаточно заметно. Ввиду того, что на аноде происходит растворение и серебра и меди, а на катоде выделяется только серебро, электролит непрерывно обогащается медью и обедняется серебром.
Для предотвращения заметной катодной поляризации электролит должен содержать не менее 6—10 г/л серебра, обычно его содержание колеблется в пределах 15—25 г/л. Концентрацию азотной кислоты в растворе держат не выше 10 г/л. При таком составе электролита серебро осаждается на катоде в виде крупнокристаллического рыхлого осадка, дающего дендриты и легко отделяющегося от электрода. Осадок скребками счищается с катода и падает на дно ванны. Электролиз с получением плотных осадков при рафинировании серебра не проводят.
Так как электролит все время обедняется серебром и азотной кислотой, в ходе электролиза в него добавляют периодически AgNО3 и HNО3. Добавку производят до тех пор, пока электролит настолько не обогатится медью, что станет возможным ее соосаждение на катоде. После этого часть электролита отбирают, заменяя его свежим раствором. Из отобранной порции электролита производят осаждение серебра цементацией его медью. Цементное серебро после переплавки направляется вновь на электролитическое рафинирование.
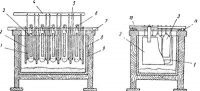
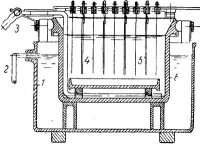
Рис. 2. Ванна для рафинирования серебра с вертикальными анодами:
1 — щетка-скребок; 2 — катод; 3 — анод; 4 — рама крепления скребков; 5— катодная штанга-6 —анодная штанга; 7 —деревянный корпус; 8 — анодный мешок; 9 — эбонитовый сосуд;
10 — катодная шина; 11 — анодная шина.
Плотность тока, применяемая при электролизе серебра, зависит от чистоты анодного металла. Высокие катодные плотности тока применяются, если аноды не содержат меди. Высокая анодная плотность тока вследствие анодной поляризации создает условия для растворения палладия и платины, которые в этом случае неизбежно будут осаждаться на катоде.
1000X600x500 мм. Катод имеет размер 400X500 мм; анод (при расположении по ширине ванны в ряд трех анодов) —250Х150Х Х15 мм. Расстояние между электродами 50—60 мм, между осями одноименных электродов около 200 мм. Напряжение на ванне равно 1—2 в. Плотность тока составляет обычно 200—300 a/м2. При высокочистых анодах (950 проб по серебру) плотность тока может быть повышена до 300—400 а/м2 при низкопробных!анодах — уменьшается до 180—200 а/м2.
Выход по току (катодный) достигает 95—97%. Удельный расход энергии колеблется от 0,4 до 0,6 квт • ч на 1 кг серебра. Температура электролита за счет тепла, выделяемого током, достигает 40—50° С. Выход анодного скрапа («обсосков») составляет 12— 18%. Скрап направляют на переплавку или на доработку в ванны с горизонтальными электродами.
Длительность растворения анодов составляет обычно 2—3 суток. После этого все электроды вынимают, и из ванны извлекают катодный осадок. Осадок отделяют от раствора и тщательно промывают горячей водой Промытое серебро сушат и направляют на переплавку. Чистота катодного серебра обычно не ниже 99,95%.
Ванна с горизонтальными электродами (системы Тума — Бальбаха) представляет собой прямоугольный сосуд, изготовленный из кислотоупорной керамики с наклонно расположенной частью дна. В качестве катода служит графитовая пластина, положенная на дно ванны. Аноды укладывают в дырчатые ящики находящиеся в верхней части ванны, и отделяют от дна ящиков матерчатым фильтром. Сверху аноды прижимают пластиной с токоподводом. Катодное серебро собирается в виде кристаллов на графитовом катоде и периодически выгребается через наклонную часть ванны. Так как ванна не нуждается в счистке кристаллов серебра с катода, то одновременно отсутствует и перемешивание раствора. Отсутствие перемешивания заставляет применять электролит с повышенным содержанием серебра (20—25 г/л серебра вместо 15—20 г/л в ваннах с вертикальными электродами).
Обычно такие ванны изготовляют размером 1220X660X250 мм. Расстояние между дном анодного ящика и катодом около 100 мм.
Главное достоинство ванн с горизонтальными электродами малый выход анодного скрапа (~2%). Положительными качествами их являются также простота конструкции, удобство обслуживания и дешевизна.
Большое расстояние между электродами (необходимое для возможности извлечения катодного серебра), несовершенный контакт на аноде и сопротивление шлама приводят к увеличению напряжения на ванне до 3,2—3,8 в.
Слабая циркуляция электролита способствует более интенсивному протеканию реакций восстановления ионов NO-3, что снижает катодный выход по току до 87—90% и повышает расход азотной кислоты. Увеличенное напряжение на ванне и пониженный катодный выход по току ведут к возрастанию удельного расхода электроэнергии до 1,0—1,2 квт • ч на 1 кг серебра.
Недостатком этого типа ванн является также большая площадь, занимаемая ими в цехе по сравнению с ваннами с вертикальным расположением электродов.
Плотность тока на аноде и на катоде вследствие разницы в величине их поверхностей различна: на катоде она составляет 200—250 а/м2, на аноде 400—500 а/м2.
Ванны с горизонтальными электродами не получили широкого применения. Обычно их используют в качестве вспомогательных для переработки анодного скрапа ванн с вертикальными электродами.
Электролитическое рафинирование золота
Хлорид золота АuСl3, будучи растворен в чистой воде, частично дает комплексное соединение Н2АuСl3О, диссоциирующее по схеме
Н2АuСl3O ⇄ 2Н+ + АuСl3O2-
Раствор имеет кислую реакцию. При электролизе этого раствора с золотым анодом наряду с растворением последнего протекает реакция разряда ионов АuСl3O2-, сопровождающаяся выделением кислорода. Это приводит к пассивированию анода. При пассивации переход золота в раствор прекращается, и потенциал электрода возрастает до величины потенциала выделения кислорода и разряда ионов Сl— (потенциал выделения хлора в таких растворах равен +1,75 в). Поэтому на аноде идет выделение газообразных хлора и кислорода.
Если раствор хлорида золота подкислить соляной кислотой, то образуется золото хлористоводородная кислота НАuСl4:
АuСl3 + НСl → НАuСl4
Одновременно и Н2АuСl3O взаимодействует с НСl:
Н2АuСl3O + НСl → HAuCl4 + H2O
Чем выше концентрация соляной кислоты, тем больше реакция сдвигается вправо, тем меньше в растворе концентрация ионов АuСl3O2- и тем труднее происходит пассивирование анода. Однако при данной концентрации соляной кислоты повышение плотности тока, сопровождающееся повышением анодного потенциала может привести к тому, что при некотором критическом значении этой плотности тока вновь окажется возможным выделение кислорода и, как следствие, пассивирование анода и выделение хлора. Чем больше кислотность раствора и чем выше температура, тем больше величина критической плотности тока.
Таким образом, процесс растворения анода определяется соотношением трех факторов: плотности тока, содержания в растворе соляной кислоты и температуры.
Золото хлористоводородная кислота НАuСl4 диссоциирует в растворе по схеме
НАuСl4 ⇄ Н+ + AuCl—4
Ион АuСl—4 также частично диссоциирует:
AuCl—4 ⇄ Аu3++4Сl—
Количество ионов Аu3+ в растворе весьма мало, и золото преимущественно находится в виде AuCl—2: В соответствии с этим растворение золота на аноде происходит, в основном, по следующей схеме:
Аu +4Сl— —3e → АuСl—4(φ°Au|Au3+ = + 1,59в)
Наряду с этим растворение золота происходить с образованием ионов AuCl—2:
Аu + 2Сl— — e → AuCl—2(φ°Au|Au+ = + 1,68в)
Ион AuCl—2 соответствует золотисто хлористоводородной кислоте HAuCl2. Эта кислота менее устойчива, чем НАuСl4.
Между золото хлористоводородной и золотисто хлористоводородной кислотами в растворе устанавливается равновесие:
3HAuCl2 ⇄ HAuCl4+2Au+2HCl
Константа равновесия этой реакции в отличие от аналогичной константы равновесия ионов Сu2+ и Сu+ имеет значительно меньшую величину, и концентрация ионов одновалентного золота АuCl—2 в растворе оказывается значительной. Это приводит к тому, что на катоде, равно как и на аноде, электродное реакции с ионами одновалентного золота получают большое развитие, причем тем большее, чем меньше поляризация электрода. При этом выход по току золота в расчете на трехвалентное оказывается заметно выше 100%, однако, в различной степени на катоде и на аноде. Анодный выход по току составляет около 125—130% против 110—115% катодного выхода по току, таким образом на аноде растворяется заметно больше золота, чем осаждается на катоде.
При равновесном потенциале растворение золота на аноде в виде трех- и одновалентного должно происходить в количествах, отвечающих константе равновесия реакции. В условиях поляризации, однако, количество образующегося одновалентного золота превышает эту величину, поэтому в ходе процесса всегда наблюдается нежелательное выпадение золота в шлам, причем, в отличие от аналогичного выпадения металлической меди в ходе ее электролитического рафинирования, количество выделившегося золота может быть весьма значительно (до 10% от растворенного).
Поэтому, несмотря на большую скорость растворения анода, раствор в ходе электролиза постепенно обедняется золотом.
При растворении золотого анода почти все примеси, содержащиеся в нем (медь, свинец, никель, платина и др.), также растворяются и переходят в электролит. Серебро сразу же образует осадок AgCl, который частично выпадает в шлам, частично же, при содержании серебра в золоте свыше 3—4%, образует на аноде плотную пленку. Последняя вызывает солевую пассивацию анода, препятствующую его растворению. В этом случае осадок AgCl необходимо все время удалять с электрода. Родий, рутений, осмий и иридий, находящиеся в золотом аноде, не растворяются и переходят в шлам.
Золото настолько электроположительное большинства металлов, что выделения на катоде примесей обычно опасаться не приходится. Наибольшей возможностью соосаждения с золотом обладают платина и палладий. В электролите допустимо содержание до 50—60 г/л Pt и 15 г/л Pd (в отсутствие палладия допустимо содержание платины до 80 г/л).
Из накапливающихся в электролите примесей «ведущей» (т. е. определяющей необходимость регенерации электролита) обычно оказывается медь. Ее содержание в растворе допускается не свыше 150 г/л. Определенную опасность представляет также свинец, так как РbСl2 растворим в электролите ограниченно и может образовывать на аноде пассивирующую пленку. Свинец удаляют из раствора, добавляя в электролит серную кислоту, которая со свинцом образует нерастворимый сульфат свинца.
Электролиз ведут в растворах, содержащих 50—70 г/л, Аu и 60—70 г/л НСl. Когда в электролите содержание примесей достигнет предельной концентрации, его направляют на переработку. Температуру электролита поддерживают в пределах 60—70° С. Свежий электролит заливают при 45° С, дальнейшее его нагревание осуществляется специальными подогревателями.
Особенностью электролитического рафинирования золота является то,что его проводят обычно непостоянным, а переменным асимметричным током. Для этого последовательно с генератором постоянного тока включают генератор переменного тока с э. д. с. немного более высокой, чем э. д. с. постоянного тока. Применение асимметричного тока вызвано необходимостью удаления с поверхности анода пленки хлорида серебра, пассивирующей анод при содержании в нем серебра выше 4—5%.
При приложении к ванне асимметричного напряжения анод на короткое время становится катодом (отрезок t2), при этом пленка хлорида серебра отделяется от электрода и падает в шлам. Использование асимметричного тока позволяет вести электролиз с анодами, содержащими 10—20% серебра и выше. Чем больше содержание в анодах серебра, тем больше приходится брать отношение. Uпер : Uпост Ванна для электролиза золота представляет собой фарфоровый сосуд прямоугольной формы емкостью 10—20 л (рис. 3). Его помещают обычно внутрь другого большего сосуда, который изготовляется из железа, покрытого кислотоупорной эмалью.
Наружный сосуд служит термостатом, в него наливают воду, подогреваемую с помощью нагревателей. Аноды в ванне располагают по три или по четыре в ряд и подвешивают на штангах при помощи вплавленных в аноды золотых лент или крючков. Катоды изготовляют ИЗ рифленой золотой жести и укрепляют на штангах аналогично.
Рис. 3. Ванна для рафинирования золота:
1 — сосуд термостата; 2 —штуцер для подвода нагревающей воды; 3 — штуцер для подачи воздуха для перемешивания; 4 — катод; 5 — анод; 6— фарфоровая ванна.
Для рафинирования серебра применяются в основном, ванны двух типов: с вертикальным и горизонтальным расположением, электродов.
Ванны первого типа (система Мебиуса) представляют собой керамические, или эбонитовые сосуды прямоугольной формы (рис. 3).
На анодной штанге закреплены от 1 до 3 анодов, расположенных в ряд. Катод обычно делается один на всю ширину ванны. Аноды заключены в чехлы (мешки) из полотна или другого материала. При растворении анода шлам, падая с электрода, собирается на дне мешка. Таким образом, катодный металл не засоряется шламом. На дне ванны помещают дырчатый деревянный или эбонитовый ящик для сбора катодного серебра. Катодные основы изготовляют из тонкого листового алюминия, серебра или нержавеющей стали. Приставшие к катоду кристаллы серебра сбивают вручную или механически специальными скребками-щетками, которые одновременно играют роль мешалок.
Система включения электродов в ванне — параллельная, число параллельно включенных рядов анодов в ванне обычно 4, катодов— на один больше. Как правило, ванны изготовляют размером анодам. Подводку тока к электродам осуществляют при помощи шин, расположенных параллельно бортам ванн на специальных подставках. На шины опираются электродные штанги. Электроды в ванне соединяют параллельно. Электролит в ваннах перемешивают воздухом или мешалками. Аноды изготовляют размером 100X60, 200X80 или 260X160 мм; толщина их 5—8 мм. Вес анода 0,5— 6 кг. Толщина катодной основы 0,15—0,25 мм. Расстояние между электродами около 30 мм. Плотность постоянного тока 500—1500 а/м2. Общая плотность тока 1000— 3000 а/м2. Напряжение на ванне 0,6—0,8 в; расход энергии 0,3—0,35 квт • ч на 1 кг золота.
Золото на катоде отлагается в виде плотного осадка. Катоды промывают соляной кислотой и пускают на переплавку. Чистота катодного металла обычно не ниже 999,9 проб.
Свежий раствор хлорида золота (III) для рафинирования получают в специальных ваннах растворения (рис. 16). Ванны имеют цилиндрическую форму и их изготовляют из фарфора. В них устанавливают кольцевую пористую фарфоровую диафрагму; по одну сторону диафрагмы подвешивают аноды из рафинированного золота, по другую — обычные катоды. В анодное пространство заливают более концентрированную (2:1), а в катодное— более разбавленную (1:1) соляную кислоту. Электролиз ведут при напряжении 3—4 в и плотности тока 1000—1500 а/м2. При этом на анодах происходит растворение золота, а на катодах— выделение водорода. Анолит обогащается золотом. Указанным способом можно получить раствор хлорида золота (III) высокой концентрации (350—450 г/л Au).
Статья на тему Электролитическое рафинирование


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.