Теория:
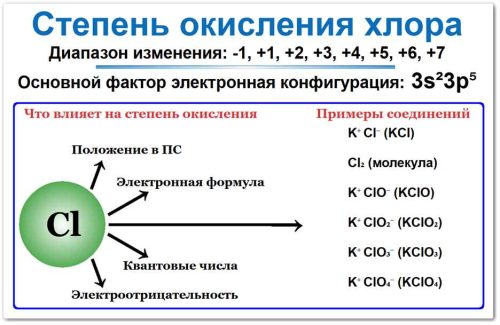
Хлор проявляет переменные степени окисления в диапазоне от −1 до +7.
Так как это обусловлено его положением в 17‑й группе (VIIA)
Периодической системы и электронной конфигурацией 3s2 3p5.
Его высокая электроотрицательность (3,16) заставляет его притягивать один электрон, чтобы стать стабильным ионом Cl⁻ (это -1).
Однако, наличие свободных 3d-орбиталей (что объясняется квантовыми числами n = 3, l = 2) позволяет хлору распаривать свои электроны и использовать их все для связей с более электроотрицательными атомами (Кислородом или Фтором).
Именно это дает ему возможность достигать всех положительных степеней окисления, вплоть до +7.
Почему степень окисления может быть отрицательной (−1)
Электроотрицательность хлора ≈ 3,16 (по Полингу) — одна из самых высоких среди элементов.
Задача атома: получить 1 электрон для завершения внешнего электронного слоя (достижения конфигурации аргона).
Результат: в соединениях с менее электроотрицательными элементами (например, Na в NaCl или H в HCl) хлор притягивает электрон, приобретая степень окисления −1.
Следствие: −1 — низшая степень окисления хлора, типичная для хлоридов.
Почему степень окисления может быть положительной (+1, +3, +5, +7)?
Положительные степени окисления возникают, когда хлор связывается с более электроотрицательными элементами — прежде всего с кислородом (ЭО ≈ 3,44) и фтором (ЭО ≈ 4,0).
Механизм: при возбуждении электроны с 3s‑ и 3p‑орбиталей «распариваются» и переходят на свободные 3d‑орбитали (n = 3, l = 2).
Это увеличивает число неспаренных электронов:
- 1 неспаренный → СО = +1;
- 3 неспаренных → СО = +3;
- 5 неспаренных → СО = +5;
- 7 неспаренных → СО = +7.
Следствие: +7 — высшая степень окисления хлора (например, в HClO4).
Примечание: хотя теоретически возможны и чётные степени окисления (+2, +4, +6), они крайне редки и неустойчивы (например, ClO2 — оксид хлора(IV), где Cl имеет СО = +4).
Влияние электроотрицательности (ЭО)
Электроотрицательность — ключевой фактор, определяющий степень окисления хлора:
Если ЭО партнёра < ЭО(Cl): хлор притягивает электрон → СО = −1 (NaCl, HCl).
Если ЭО партнёра > ЭО(Cl) (O, F): хлор отдаёт электроны → положительные СО (+1 … +7).
В молекуле Cl2: СО = 0 (одинаковая ЭО у обоих атомов).
Квантово‑механическое обоснование (почему возможны СО > −1?)
Возможность положительных степеней окисления объясняется электронной структурой и наличием свободных d‑орбиталей:
Валентные электроны: 7 электронов на 3s2 3p5.
Свободные орбитали: на третьем энергетическом уровне (n = 3) есть незаполненные 3d‑орбитали (l = 2).
Возбуждение: при образовании связей электроны могут переходить на 3d‑орбитали.
Увеличивая число неспаренных электронов и позволяя хлору формировать до 7 ковалентных связей.
Примеры соединений с разными степенями окисления хлора
−1: NaCl (хлорид натрия), HCl (хлороводород);
0: Cl₂ (молекулярный хлор);
+1: HClO (хлорноватистая кислота), NaClO (гипохлорит натрия);
+3: HClO2 (хлористая кислота), NaClO2 (хлорит натрия);
+5: HClO3 (хлорноватая кислота), KClO3 (хлорат калия);
+7: HClO4 (хлорная кислота), KClO4 (перхлорат калия).
Вывод
Диапазон СО хлора: от −1 до +7 (преимущественно нечётные значения).
−1 — низшая степень окисления, типична для соединений с металлами и водородом.
+1 … +7 — положительные степени окисления, возникают при взаимодействии с O и F.
0 — степень окисления в простом веществе (Cl2).
Обоснование: электронная конфигурация (3s2 3p5) и наличие свободных 3d‑орбиталей позволяют хлору проявлять разнообразные степени окисления.
Электроотрицательность (3,16) — главный фактор, определяющий окислительно‑восстановительные свойства хлора.
Хлор — высоко электроотрицательный элемент с переменной степенью окисления.
Его способность к возбуждению и использованию d‑орбиталей объясняет широкий диапазон СО от −1 до +7.
В природе и химии наиболее распространены соединения с СО = −1, +1, +5 и +7.
Пример решения, задача:
▶️ Дано:
Соединение KClO4 (перхлорат калия)
⌕ Найти:
Степень окисления Cl (СО) в этом соединении.
✨ Решение:
Известны постоянные (или типичные) степени окисления:
Запишем уравнение баланса зарядов для KClO4 (сумма степеней окисления всех атомов равна 0, так как молекула нейтральна):
(+1) + x + 4 ⋅ (−2) = 0,
где x — степень окисления хлора (Cl).
Решаем уравнение:
1 + x − 8 = 0
x − 7 = 0
x = +7.
✅ Ответ:
Степень окисления хлора в соединении KClO4 (перхлорат калия) равна +7.
Часто задаваемые вопросы:
−1, потому что хлор легко принимает 1 электрон, завершая внешний электронный слой (конфигурация благородного газа). Типичные соединения: NaCl, HCl.
Да, +1, +3, +5, +7, при взаимодействии с более электроотрицательными элементами (O, F) хлор отдаёт электроны.
Из‑за электронной конфигурации (3s23p5) и механизма возбуждения.
При возбуждении электроны распариваются так, что число неспаренных электронов становится нечётным (1, 3, 5, 7).
Чётные степени окисления возможны лишь в нестабильных молекулах (например, ClO2, где Cl = +4), но не в устойчивых ионах.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.