ВОССТАНОВЛЕНИЕ МЕТАЛЛОВ
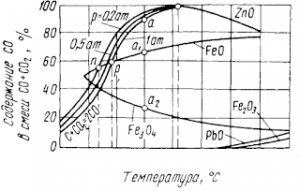
Рис. 5. Условия восстановления некоторых окислов углеродом
Восстановление углеродом или водородом
Наиболее доступный и дешевый восстановитель — углерод— составляет основную массу каменных углей. Восстановление углеродом, например окиси двухвалентного железа, можно записать следующими уравнениями:
FeO + C = Fe + CO,
FeO + СО Fe + СО2.
Подобные реакции идут вправо — в сторону восстановления, если прочность химической связи кислорода с углеродом больше прочности связи его с металлом. Как известно, прочность химической связи называют сродством, которое в термодинамике измеряют величиной стандартного термодинамического изобар-но-изотермического потенциала, обозначаемого символом ΔZ°. Сродство выражают в Джоулях. Физический смысл его — максимальная работа, которую может совершить реакция. Ее условно считают отрицательной, поэтому отрицательная величина ΔZ° указывает на работоспособность реакции — возможность самопроизвольного ее протекания. Говоря ниже об увеличении термодинамического потенциала, мы будем понимать это, как сдвиг ΔZ в отрицательном направлении. Применение уравнений химической термодинамики часто затруднено отсутствием исходных данных и сложностью расчетов. Более удобны полуэмпирические зависимости ΔZ от температуры типа
ΔZ°Т = А + BTlgT + cT + ••• ,
здесь Т—абсолютная температура, К, а постоянные коэффициенты А, В, С приведены в справочниках. Для расчета сложных реакций формулу комбинируют с известным уравнением
ΔZ°Т = ΣΔZK — ΣΔZH,
где T—температура, К, а индексы к и н обозначают полученные и исходные вещества.
Например, реакцию (1) можно представить в две стадии:
I. 2FeO = 2Fe + O2 ; ΔZ°Т = — 2 (— 62050 + 14,95T); от 298 до1642К
II. 2C + O2 = 2CO; ΔZ°Т = 2 (— 26700 — 20,95T); от 298 до 2500 К
2FeO + 2C = 2Fe + 2CO; ΔZ°Т= 70700 — 71,8T; от 298 до 1642 К.
Из этого легко определить, при какой температуре восстановление железа в стандартных условиях (при рсо = 101325 Па). Давления паров Fe и FeO приняты постоянными, поскольку они находятся в равновесии с соответствующими конденсированными твердыми или жидкими фазами. При равновесии реакции ΔZ0Т = 0.
Следовательно:
70700 = 71,80T;
T = 70700 : 71,80 = 985K(721° С)
Приведенный расчет сравнительно прост из-за отсутствия в нужных для него уравнениях члена, содержащего lg Т. В других случаях для получения ориентировочных результатов удобнее пользоваться графиками.
Для реакции (5) при 800° С (1073 К):
РbО + С = Рb + СО (5)
находим (округленно):
ΔZ°PbO = — 82 кДж; ΔZ°CO = — 238 кДж;
ΔZ° = — 238 — (— 82) = — 156 кДж.
Разность получилась отрицательной, следовательно, реакция возможна. Заметим, что линии РbО и СО на рис. 4 пересекаются при температуре около 350° С. Влево от пересечения разность сродства окажется положительной, а восстановление — невозможным; эта точка определяет температуру начала восстановления свинца углеродом при стандартных условиях —(pсо = 101325 Па). Также по пересечению соответствующих линий можно определить температуры начала восстановления других, окислов; для SiO2, Аl2O3, CaO, MgO они выше 1500°C.
Очевидно, можно выбрать условия, при которых одни окислы восстанавливаются до металла, а другие остаются неизменными.
На этом основана, например, выплавка свинца из руд, содержащих окислы железа, кремния, кальция. При свинцовой плавке восстанавливается только свинец, имеющий сравнительно малое сродство к кислороду. Другие окислы сплавляются в жидкий шлак (плотность γ=3000÷3500 кг/м3), всплывающий над свинцом (γРb≈ 10000 кг/м3), подобно тому, как слой масла всплывает над водой.
Очень важна скорость восстановления: металлургические переделы должны быть производительными, а для этого надо, чтобы входящие в них реакции протекали быстро.
Твердые окислы восстанавливаются твердым углеродом медленно из-за малой поверхности контакта реагирующих веществ; даже при тонком измельчении частицы соприкасаются неплотно. К тому же продукт реакции — металл, возникающий в местах контакта, затрудняет дальнейшее взаимодействие. Твердый углерод может быть энергичным восстановителем только, если поверхность его омывается жидким или газообразным окислом. Твердые окислы восстанавливаются преимущественно газообразной окисью углерода:
МеО + СО = Ме + СO2,
получаемой по реакции, равновесие которой изучили Будуар и Белл:
С + СO2= 2СО.
В расплавах, плохо смачивающих углерод, а такие встречаются часто, частицы его окружены газовой пленкой из СО и СО2. Восстановление здесь происходит также через газовую фазу. Константу равновесия реакций надо записать отношением парциальных давлений СО2 и СО. Давления паров MeO, Me и углерода при их избытке постоянны, они входят в величину Kр, поэтому
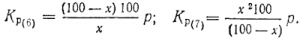
Обе константы равновесия можно выразить процентными соотношениями СО и СО2. Обозначив содержание в процентах СО в смеси через x, а СО2 — через 100—х, найдем
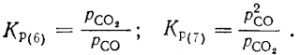
Величины Kр зависят от давления и температуры, данные об этом приведены на рис. 5. Показанные здесь окислы могут восстанавливаться, если СО в равновесных газах реакции (7) больше, чем необходимо для реакции (6). Например, при температуре 800° С можно восстановить FeO и Fe3O4. точка а лежит выше а1 и а2, но нельзя получить цинк из его окиси. Точки n и р соответствуют началу восстановления FeO при общих давлеяниях смеси СО+СО2 соответственно 20265 и 101325 Па — при температурах около 630 и 680° С. Цинк восстанавливается при всех давлениях близ 930° С, различие, связанное с давлением, и здесь имеется, но оно невелико и неразличимо на графике.
Температуры начала восстановления Fe2О3 и РbО очень малы вследствие малого сродства к кислороду; однако в действительности они выше вычисляемых термодинамически из-за малых скоростей взаимодействия. Термодинамически получаются необходимые, а не достаточные условия восстановления, последние требуют еще и учета кинетики реакций. Например, углерод при обычных температурах практически не окисляется, уголь может лежать на воздухе веками, хотя термодинамический потенциал образования СO2 равен — 393,8 кДж уже при 25° С.
Согласно правилу акад. А. А. Байкова, высшие окислы восстанавливаются последовательно, в частности:
3Fe2O3 + СО = 2Fe3O4 + СO2; ΔН098 = — 52,3 кДж,
Fe3O4 + СО = FeO + СO2; ΔН0298 = 35,5кДж,
FeO + СО = Fe + СO2; ΔН0298 = — 13,2кДж
Теплоту, выделяемую реакцией, здесь и далее условимся считать отрицательной; ΔН0<0 — термодинамический признак экзотермичности. Заканчивая обсуждение рис. 5, заметим также, что для равновесия реакций восстановления РbО и Fe2O3 с повышением температуры требуется более высокое содержание СО в газах, а для FeO и ZnO — меньшее.
По принципу Ле-Шаталье, при внешнем воздействии на равновесную систему в ней возникают противодействующие процессы. Если реакция экзотермическая [ΔН<0, уравнения (8) и (10)] при повышении температуры требуется большее содержание восстановителя — СО в газах. Наоборот, реакции восстановления Fe3О4 (9) и ZnO поглощают тепло (ΔН>0); при высоких температурах равновесное парциальное давление СО в газах здесь снижается.
Водород для восстановления окислов применяют реже, он дороже и взрывоопасен, но необходим в тех случаях, когда углерод может образовать с металлами иногда нежелательные карбиды, например при восстановлении вольфрама и молибдена:
WO3 + 3C = W + 3C,
МоO3 + 3С = Mo + 3СО.
Реакциям (11) и (12) сопутствует частичное образование карбидов WC и Мо2С.
Восстановителями окислов могут служить непредельные углеводороды, входящие в состав природного газа и нефти.
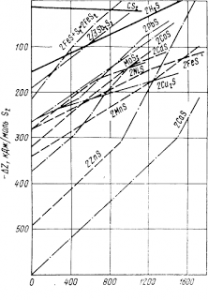
Многие металлы представлены в природе сульфидами, для оценки возможности восстановления которых по реакции 2MeS + C = Me + CS2
рассмотрим рис. 6, характеризующий сродство элементов к сере В большинстве случаев углерод не пригоден для непосредственного восстановления сульфидов. Также мало пригоден для и водород: линия H2S расположена высоко, что указывает редкую возможность реакций типа:
MeS + H2 = Me + H2S.
В металлургической практике природные сульфиды сначала обжигают: нагреванием при доступе воздуха переводят в окислы, которые затем восстанавливают углеродом. Например, сульфид свинца — галенит окисляют при температуре около 1000° С:
2PbS + 3О2 = 2PbO + 2SО2.
Окись свинца восстанавливают углеродом. Также получают из сульфида цинк. Надо отметить, что на рис. линия ZnO имеет излом, соответствующий точке кипения металла при 907° С. Восстанавливаясь при температуре около 930° С, цинк получается в виде паров, которые отводят из печи, охлаждают и конденсируют в виде жидкого или твердого металла (в зависимости от температуры в конденсаторе). Заметим попутно, что подобные изломы прямых на рис. указывают на изменение агрегатного состояния — плавление либо кипение металла или его соединения.
Константу равновесия реакции при 1000° С:
ZnOTB + СО = Znпap + СО2,
надо записать с учетом парциального давления паров цинка, которые здесь неравновесны с жидким металлом:
Связь между величинами ΔZ0 и К выражается уравнением изотермы из которого при подстановке R = 8,326 Дж/ (град • моль) и замене натурального логарифма десятичным получим
ΔZ0 = — 19,1TlgK[кДж].
Статья на тему Восстановление металлов


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.