Природа тока, ток в электролитах Законы Фарадея
В процессе растворения дипольные молекулы воды располагаются вокруг молекулы электролита так, что каждый ион окружается противоположными по знаку заряда концами молекул воды.
Силы притяжения между ионами ослабляются, и молекула распадается на ионы. Этот процесс называется электролитической диссоциацией. Ионы, сталкиваясь между собой в процессе теплового движения, могут рекомбинироваться в молекулу. Этот процесс называется молизацией.
Если в раствор электролита поместить металлические или угольные электроды и присоединить их к полюсам генератора постоянного напряжения, то между электродами образуется электрическое поле. Под действием поля скорости ионов, находящихся в беспорядочном тепловом движении, получают составляющие в направлении действия сил поля и ионы начинают перемещаться между электродами вдоль линий напряженности поля.
Это движение ионов и образует электрический ток. Движение ионов происходит во всем объеме раствора, находящегося между электродами. Скорость ионов невелика, так как при движении они испытывают столкновения с молекулами растворителя (воды), а также нераспавшимися молекулами самого электролита.
От чего зависит скорость движения ионов
Скорость движения ионов зависит от их природы, температуры раствора, а также от напряженности электрического поля. Скорость движения ионов (в см/сек), отнесенную к единице напряженности поля (1 в/см), называют подвижностью ионов. Подвижности измеряют в см2/(в•сек). При повышении температуры вязкость раствора уменьшается, в связи с чем подвижность ионов повышается примерно обратно пропорционально изменению коэффициента вязкости
Подвижность некоторых ионов при температуре раствора 18° С приведена в таблице.
| Ион | подвижность в см2/(в•сек),х10-4 | Электрохимический эквивалент в мг/к |
| Водород (Н+) | 32,6 | 0,010 |
| Натрий (Na+) | 4,5 | 0,238 |
| Калий (К+) | 6,7 | 0,405 |
| Кальций (Са++) | 5,2 | 0,208 |
| Хлор (Сl—) : . | 6,8 | 0,367 |
| Иод (J—) . . | 6,6 | 1,315 |
| Радикал (NO3)— | 6,4 | 0,643 |
| Радикал (SO4)— | 6,9 | 0,498 |
Движение ионов можно показать следующим опытом (рис. 2). На стеклянную пластинку П наложен лист фильтровальной бумаги, пропитанной раствором сернокислого натрия (Na2SO4), с примесью фенолфталеина и посредине его нитка Н, смоченная раствором едкого натрия (NaOH). Ионы гидроксила (ОН—) из едкого натра, взаимодействуя с фенолфталеином, окрашивают нитку и бумагу под ней в яркий малиновый цвет.
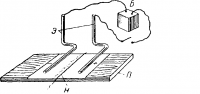
Вследствие различной скорости поступательного движения ионов противоположного знака они неравномерно участвуют в образовании тока.
Доля участия данного иона в образовании тока в растворе электролита называется его числом переноса а. Сумма чисел переноса анионов аа и катионов ак равняется единице:
аа+ак=1.
Для растворов слабой концентрации числа переноса анионов и катионов прямо пропорциональны их подвижностям:
аа/ак = ua/uк
Совмещая эти две зависимости, можно вычислить число переноса:
аа = ua\(ua + uк) и ак = uк/(ua + uк)
Передвигаясь в растворе, ионы достигают электродов и, нейтрализуя заряды, превращаются в атомы соответствующего вещества. На аноде отрицательные ионы отдают лишние электроны, которые поступают во внешнюю цепь и поддерживают ток в ней. На катоде положительные ионы присоединяют электроны, поступающие из внешней цепи (см. рис. 222, б). Эти процессы называют первичными реакциями на электродах.
За единицу времени как на положительном, так и отрицательном электродах нейтрализуют свои заряды равные количества ионов (считая их валентность одинаковой). Поэтому более подвижные ионы не успевают полностью нейтрализовать свои заряды, накапливаются около электрода и образуют пространственный заряд противоположного по отношению к электроду знака.
Таким образом, при прохождении тока через электролит происходит постепенное убывание ионов из раствора. Количество ионов пополняется путем дальнейшей диссоциации молекул растворенного вещества. Пока средняя концентрация ионов в растворе остается неизменной, сила тока подчиняется закону Ома. Если пополнение убыли ионов прекратится, то ток через электролит ослабляется и затем прекращается.
Растворы электролитов характеризуются удельной электропроводностью, которая указывается для см3 раствора, и соответственно имеет размерность 1/(ом • см) или ом-1•сек-1.
При повышении температуры вследствие увеличения подвижности ионов электропроводность растворов электролитов увеличивается.
Жидкие среды организма (плазмы крови, лимфа, различные тканевые жидкости) содержат слабые растворы электролитов, преимущественно поваренной соли. Общая концентрация этих растворов эквивалентна 0,9% раствору поваренной соли. Удельная электропроводность подобного раствора в зависимости от температуры приведена в таблице.
Первый закон Фарадея
Процессы разложения электролита с выделением соответствующих веществ на электродах, которые происходят под действием электрического тока, называются электролизом. Законы электролиза были установлены Экспериментально Фарадеем и носят его имя I закон Масса m выделившегося на электроде вещества прямо пропорциональна количеству электричества q, протекшего через электролит:
m = kq = kIt,
| Температура в °С | Удельная электропроводность в ом-1•сек-1 х10-3 |
| 0 | 8,3 |
| 18 | 13,15 |
| 25 | 15,20 |
| 50 | 23,4 |
где m подставляется в мг, q — в кулонах, I — сила тока в а, t — время действия тока в сек.
Коэффициент пропорциональности k называется электрохимическим эквивалентом и зависит только от природы вещества. Численно он равен массе вещества (в мг), выделившегося при прохождении через электролит единицы количества электричества в 1 к. В свое время это использовалось-для определения кулона, как количества электричества, необходимого для выделения на катоде 1,118 мг (электрохимический эквивалент) серебра из раствора его азотнокислой соли.
Электрохимические эквиваленты некоторых веществ приведены в таблице (см. стр. 168).
Второй закон Фарадея
II закон. Электрохимические эквиваленты k элементов прямо пропорциональны их химическим эквивалентам (химический эквивалент равен отношению атомного веса А к валентности п элемента в данном соединении):
k = C (А/n),
где С—коэффициент пропорциональности, не зависящий от природы элемента. Обычно его выражают как С = 1/F , где F — величина, называемая числом Фарадея.
Совмещая формулы, выражающие I и II законы, имеем m = (1/F)(A/n)q. При m = A/n получаем F = q т. е. число Фарадея равно количеству электричества, проходящего через электролит при выделении на каждом из электродов одного грамм-эквивалента вещества; F = 96 494 (округленно 96 500) к/г-экв.
Число атомов в грамм-эквиваленте простого одновалентного вещества равняется числу Авогадро. Поэтому отношение чисел Фарадея F и Авогадро Na позволяет определить элементарный электрический заряд одновалентного иона, равный заряду электрона:
е = F/NA = 96500/(6,033•1023) = 1,6•10-19к.
Вторичные реакции на электродах
Не всегда в результате электролиза на электродах выделяются те вещества, ионы которых образуют ток в электролите. В связи с тем что атомы и ионы одного и того же элемента могут отличаться по химической активности, вещества, первично выделяющиеся на электродах, могут вступать в химическое взаимодействие с веществом электродов или с растворителем. Это взаимодействие называется вторичными реакциями на электродах.
Рассмотрим, например, процессы, происходящие на электродах, погруженных в слабый раствор поваренной соли. При растворении в воде молекулы поваренной соли диссоциируют на ионы натрия и хлора:
NaCl ⇄ Na++Cl—.
В растворе имеется также небольшое количество ионов диссоциированной воды:
Н2О ⇄ Н+ + ОН—,
которые также участвуют в процессе. Под действием электрического поля между электродами ионы натрия и водорода двигаются к катоду. На катоде ионы водорода (которые легче присоединяют электрон, чем ионы натрия) присоединяют электрон и превращаются в атомы водорода:
Н++е → Н.
Атомы соединяются в молекулы Н2 и выделяются в виде пузырьков газа. Ионы натрия вместе с оставшимися в растворе ионами гидроксила образуют едкую щелочь:
Na+ + OH— ⇄ NaOH.
В связи с уходом из раствора ионов водорода диссоциируют новые молекулы воды и процесс продолжается.
Ионы хлора двигаются к аноду, отдают электрон во внешнюю цепь и превращаются в атомы хлора:
Сl— → Сl + е.
Атомы хлора соединяются в молекулы Сl2 и выделяются в виде пузырьков, однако частью реагируют с водой, образуя соляную кислоту с выделением кислорода:
4Cl + 2H2O → 4HCl + O2 (реакция протекает с промежуточным образованием НOСl).
Кислород (вместе с хлором) выделяется в форме пузырьков газа на электроде.
Вторичные реакции могут не только изменить химический состав или состояние поверхности электродов (например, путем выделения пузырьков газа на его поверхности), но и вызвать появление на них разности потенциалов, обратной по знаку приложенному напряжению. К этим явлениям относится также отмеченное ранее образование около электродов пространственных зарядов противоположного знака и т. п. Все эти явления объединяются названием электролитической поляризации, а образующаяся при этом на электродах разность потенциалов называется обратной электродвижущей силой поляризации.
Покажем эти явления на опыте. Пропустим постоянный ток через два угольных электрода, опущенных в банку с раствором поваренной соли. Через некоторое время электроды (отрицательный и большей степени) покрываются мелкими пузырьками газа.
Если теперь электроды отключить от источника тока и присоединить к гальванометру, стрелка последнего отклонится, показывая наличие в цепи тока, в направлении обратном тому, в котором ток проходит под действием приложенного напряжения. Ток быстро снижается, одновременно исчезают пузырьки газа (атомы газа переходят обратно в раствор в форме ионов), покрывавшие пластины, и вскоре ток прекращается. Этот ток обусловлен ‘действием обратной электродвижущей силы поляризации, образовавшейся на электродах.
Наличие в цепи обратной э. д. с. поляризации должно учитываться путем введения ее величины Eпв формулу закона Ома:
I = (U — Eп)/R .
В связи с этим сила тока в цепи, содержащей раствор электролита, при постоянном токе меньше по величине, чем при переменном (при таком же приложенном напряжении). Кроме того, что особенно нежелательно при точных измерениях, эта сила тока не остается постоянной, а с течением времени меняется в соответствии с ходом поляризационных процессов.
При физиологических исследованиях для того, чтобы исключить поляризацию, применяют неполяризующиеся электроды. Неполяризующиеся электроды изготовляются из металла, погруженного в раствор, который образует ион этого же металла (например, в раствор соли того же металла). В этом случае при первичных реакциях на электродах происходит или растворение (на аноде), или выделение (на катоде) металла, из которого состоят электроды; вторичных реакций не происходит.
Наиболее часто применяются цинковый и серебряный неполяризующиеся электроды. Цинковый электрод состоит из цинкового стержня Э, помещенного в узкую стеклянную трубку С, наполненную раствором сернокислого цинка. Отверстие трубки закрыто пробкой П из каолина или желатины, пропитанных физиологическим раствором, снабженной кисточкой, при помощи которой электрод соприкасается с объектом О.
При прохождении тока по цепи, состоящей из источника тока Б, не поляризующихся электродов Э и объекта исследования О, представленного раствором хлористого натрия, происходит следующее. На аноде атомы цинка отдают электроны и переходят в раствор в форме ионов, избыток которых связывается ионами хлора, приходящими из объекта
Zn++ +2Cl— ⇄ ZnCl2.
В растворе появляется примесь хлористого цинка. На катоде ионы цинка приобретают электроны и выделяются в виде атомов. Остающиеся в избытке в растворе ионы радикала серной кислоты уравновешиваются ионами натрия, приходящими из объекта:
2Na+ + SO—4 ⇄ Na2SO4.
В растворе появляется примесь сернокислого натрия. После употребления раствор в обоих электродах заменяется.
Серебряный не поляризующийся электрод состоит из серебряного стержня, помещенного в раствор азотнокислого серебра, или из серебряной пластинки, покрытой электролитическим путем хлористым серебром.
Статья на тему Ток в электролитах


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.