Какие бывают процессы в газе
При изотермическом процессе внутренняя энергия идеального газа не изменяется. Применяем I начало термодинамики:
∆U = 0,
следовательно, ∆Q = ∆A, т. е. вся теплота, сообщаемая газу, идет на совершаемую им работу. Если газ расширяется, то работа против действия внешних сил совершается за счет подводимого извне тепла. Уравнение изотермического процесса: pV=const.
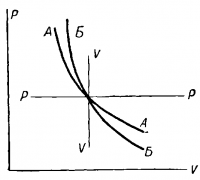
График показан на рис., кривая АА называется изотермой и представляет дугу гиперболы. Каждому значению температуры соответствует определенная кривая: чем больше температура, тем выше располагается кривая на графике.
Процесс, при котором не происходит ни поглощения, ни отдачи теплоты в окружающую среду, называется адиабатический. Такой процесс должен происходить быстро и в условиях хорошей тепловой изоляции газа от внешней среды. Применяем начало термодинамики:
∆Q = ∆U + ∆A =0,
следовательно, — ∆U = ∆A т.е. работа, совершаемая идеальным газом при расширении, происходит за счет уменьшения внутренней энергии — газ охлаждается, а юта внешних сил при сжатии газа переходит в его внутреннюю энергию и газ нагревается.
Первый из этих случаев можно показать следующим опытом. В бутыли Б, содержащей воздух и смесь паров воды и спирта, с помощью насоса Н предварительно создается повышенное давление. Затем кран К открывается и воздух, выходя наружу и быстро расширяясь, охлаждается. Пары воды и спирта конденсируются и в бутыли явно видно образование тумана (этот принцип используется, например, при устройстве камеры Вильсона).
pVγ = const,
где γ = ср/cV
(отношение тепло емкостей газа при постоянном давлении ср и при постоянном объеме cV). Для одноатомных газов при средних температурах γ =1,67, для двухатомных γ = 1,4.
График процесса показан на рис., кривая ББ. Кривая называется адиабатой и проходит по отношению к горизонтальной оси более круто, чем изотерма
В практической жизни чисто изотермические или чисто адиабатические процессы встречаются редко, все же большинство из них приближается к адиабатическим.
Процесс изменения состояния газа при постоянном давлении p = const называется изобарическим (рис., кривая РР). При этом может как изменяться внутренняя энергия газа, так и совершаться работа т.е. первое начало сохраняется в полном виде: ∆Q =∆U + ∆A.
Процесс изменения состояния газа при постоянном объеме V = const называется изохорическим. При этом газ не совершает работы ∆A = 0 Следовательно, ∆Q = ∆U, т. е. вся полученная или отданная теплота идет на изменение внутренней энергии газа.
Реальные газы Уравнение Ван-дер-Ваальса Критическая температура
Уравнение Клапейрона — Менделеева выполняется для peaльных газов в области умеренных давлений и температур и тем точнее, чем меньше давление газа и выше его температура. При низких температурах и особенно при высоких давлениях (сотни атмосфер) в уравнение необходимо вносить поправки.
Во-первых, надо учитывать силы притяжения между молекулами газа, которые расположены на более близком расстоянии, чем при небольших давлениях. Эти силы стремятся уменьшить объем газа, действуя подобно некоторому добавочному давлению р’ величина которого может быть принята обратно пропорциональной квадрату объема V газа:
р’ = a/V2 , где
а — постоянная, зависящая от природы газа. На эту величину надо увеличить давление р, которое входит в исходное уравнение.
Кроме того, если в данном объеме V газа находится значительное количество молекул, то объемом, который они занимают, пренебречь нельзя, так как на эту величину уменьшается объемом пространства, в котором могут двигаться молекулы. Поэтому в уравнении состояния газа необходимо учитывать только объем V’=V- b,где b — постоянная, учитывающая объем самих молекул.
С учетом этих поправок уравнение состояния для одного моля реального газа принимает вид, который был предложен Ван-дер-Ваальсом.
(p + a/V2μ)(Vμ — b)=RT.
К реальным газам близки свойства паров, далеких от насыщения. С молекулярной точки зрения между ними нет разницы. Практически паром называют газообразную форму тех веществ, которые при обычных температуре и давлении существуют также и в жидком или твердом состоянии, например пары воды, спирта, йода, нафталина и т. п. Газами называют вещества, которые для своего сжижения требуют особых условий в виде высокого давления и очень низкой температуры (водород, кислород, азот и т. д.).
Повышение давления газа вызывает сближение молекул: при достаточном сближении между ним начинают действовать значительные силы притяжения и газ превращается в жидкость — происходит сжижение газа. Опыт показывает, что сжижение газа в этих условиях происходит только при температурах ниже некоторой, называемой критической, характерной для данной жидкости. Это следует также и из анализа уравнения Ван-дер-Ваальса.
Понятие о критической температуре как характерной точке при изменении состояния вещества было введено Д. И. Менделеевым. При температуре выше этой точки вещество может находиться только в газообразном состоянии. Высокие скорости теплового движения его атомов или молекул препятствуют образованию между ними сил притяжения, необходимых для превращения газа в жидкость. При температурах ниже критической в зависимости от условий вещество может быть как в газообразно и в жидком состоянии или в виде равновесной системы из двух фаз: жидкости и насыщающего пара.
При критической температуре снижается до нуля как коэффициент поверхностного натяжения, так и удельная теплота парообразования.
Такие газы, как азот, кислород, водород и другие, имеют настолько низкую критическую температуру, что могут быть получены в жидком виде только с помощью весьма сложных холодильных установок.
Измерение давления газа манометры
Давление измеряют также выраженной в миллиметрах высотой ртутного столба или при малых давлениях — водяного столба. Давление в 1 мм рт. ст. соответствует давлению 13,6 мм вод. ст.
Среднее атмосферное давление на уровне моря равняется давлению ртутного столба высотой 760 мм (при 0° С). Давление, оказываемое при этом на площадь в 1 см2, называется физической атмосферой (атм). Физическая атмосфера равняется 1,033 am и соответствует давлению водяного столба высотой 10,33 м.
В метеорологии применяется также единица, называемая баром (бар). Бар соответствует давлению ртутного столба высотой 750 мм и равняется (105 н/м2). Употребляется также миллибар (мбар), равный 0,001 бар.
Приборы для измерения давления газа в закрытых сосудах называются манометрами. Манометры измеряют давление, избыточное над атмосферным, и по устройству разделяются на металлические и жидкостные (ртутные и водяные).
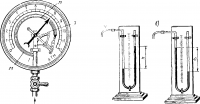
Основной частью металлического манометра является упругая металлическая трубка М, закрытая на конце и изогнутая по дуге окружности. Открытый конец трубки соединяется с сосудом, давление газа в котором измеряется. Закрытый конец трубки с помощью рычажков и зубчатого сектора 3 соединяется со стрелкой. Под действием давления газа трубка изменяет свою кривизну — распрямляется. Это движение передается стрелке, которая и указывает на шкале величину давления.
Жидкостные манометры могут быть сифонного и чашечного типа. Первые (рис. 3) состоят из U-образной стеклянной трубки, содержащей ртуть или воду. Если оба колена манометра открыты, то жидкость в них имеет одинаковый уровень. Если одно из колен соединить с сосудом, давление в котором больше атмосферного, то уровень жидкости в этом колене опустится, а в соседнем — поднимется (рис. 115, а). Давление столба жидкости, соответствующего разности уровней, соответствует давлению в сосуде.
Манометр чашечного типа состоит из открытой сверху стеклянной трубки T которая сообщается с содержащим ртуть закрытым резервуаром Р. Последний трубкой соединяется с сосудом, давление в котором измеряется. Давление, действующее на поверхность ртути в резервуаре, заставляет ее подняться в трубке на соответствующую высоту h.
Высота поднятия ртути определяется по шкале. Чашечный манометр представляет собой два сообщающихся сосуда различного диаметра: резервуар и трубку. Под действием измеряемого давления уровень ртути в резервуаре несколько понижается, соответственно понижается и начальный уровень отсчета высоты столба ртути в трубке. Для учета этого деления на шкале у трубки делаются меньше номинальных на величину, учитывающую соотношение площадей трубки и резервуара.
В некоторых случаях приходится измерять давление ниже атмосферного. Разность между этим давлением и атмосферным называется отрицательным давлением и измеряется в тех же, указанных ранее единицах. Если, например, давление газа в каком-либо сосуде по отношению к вакууму равняется 740 мм рт. ст., то его обычно характеризуют как отрицательное давление в 20 мм рт. ст.
Измерение отрицательного давления производится с помощью приспособленных для этой цели манометров. В частности, можно использовать и U-образный манометр, ртутный или водяной. Как показано на рис. 3, б, в этом случае жидкость в колене манометра, соединенном с сосудом, давление в котором измеряется, поднимается. Разность уровней жидкости h1 указывает величину отрицательного давления.
Статья на тему Процессы газа


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.