Щелочные металлы в природе
Получение и свойства щелочных металлов. Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калий принадлежат к наиболее распространенным на земле элементам: содержание натрия в земной коре составляет 2,40, а калия 2,35 весовых процента. Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлористый натрий находится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлористого калия и в виде двойных солей с натрием и магнием. Однако большие скопления калиевых солей, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются Соликамские месторождения в СНГ, стассфуртские — в Германии и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили. Сода содержится в воде многих озер. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богаз-Гол Каспийского моря, где эта соль в зимние месяцы толстым слоем осаждается на дно залива.
Значительно меньше, чем натрий и калий, распространены остальные три щелочных металла: литий, рубидий и цезий. Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Следы лития можно обнаружить в воде многих минеральных источников, в почве, а также в золе некоторых растений, как, например, свеклы, табака, хмеля. Рубидий и цезий содержатся в малых количествах в некоторых литиевых минералах.
Щелочные металлы всегда находятся в соединениях в виде положительно заряженных ионов. Так как атомы щелочных металлов очень легко окисляются, отдавая свои электроны, то ионы их, наоборот, трудно восстанавливаются. Поэтому для восстановления ионов щелочных металлов обычно прибегают к наиболее мощному восстановительному средству — электрическому току. Натрий и калий получают в технике электролизом расплавленных гидроокисей или расплавленных хлористых солей; литий получается электролизом расплавленного хлористого лития или смеси расплавленных хлористого лития и хлористого калия.
Все щелочные металлы обладают сильным металлическим блеском, который хорошо можно наблюдать на свежем разрезе металла. На воздухе блестящая поверхность металла сейчас же тускнеет вследствие окисления.
Щелочные металлы характеризуются незначительной твердостью, высокой электропроводностью, малыми удельными весами и низки-ми температурами плавления и кипения, наименьший удельный вес 0,53 имеет литий, наиболее низкую температуру плавления 28° — цезий.
Основные физические константы щелочных металлов приведены в табл. 28.
Таблица 28
Важнейшие физические константы щелочных металлов
| Константы | Литий Li | Натрий Na | Калий К | Рубидий Rb | Цезий Cs |
| Удельный вес
Темп. плавл в °С Темп, кипения в °С Радиус атома в Å |
0,53
186 1336 1,57 |
0,97 9
7,7 880 1,92 |
0,86
63 760 2,36 |
1,53
38,5 700 2,53 |
1,9
28 670 2,74 |
Щелочные металлы растворяются в жидком аммиаке, образуя коллоидные растворы, окрашенные в темносиний цвет.
Если внести в несветящее пламя газовой горелки соль щелочного металла, то она разлагается и пары освободившегося металла окрашивают пламя в тот или иной характерный для данного металла цвет. Например, литий окрашивает пламя в малиновый цвет, натрий — в желтый и т. д. Рассматривая окрашенное пламя в спектроскоп, мы увидим свойственный данному металлу спектр. Таким путем можно открыть даже незначительные следы этих элементов в исследуемом веществе.
Спектральный анализ. Многочисленные исследования спектров различных веществ, находящихся в газообразном состоянии, показали, что каждому химическому элементу, а также многим сложным веществам соответствует свой характерный спектр, отличающийся от спектров других веществ числом и расположением линий. При исследовании спектров смесей получают от каждого входящего в смесь вещества свойственный ему спектр. Таким образом, по спектру можно устанавливать присутствие тех или иных веществ в смеси. На этом основан специальный метод исследования веществ, получивший название спектрального анализа.
Спектральный анализ имеет огромное значение для химии. Особенно важным он является в тех случаях, когда исследуемое вещество имеется в ничтожном количестве. Чувствительность этого метода далеко оставляет за собою чувствительность обыкновенных химических реакций. Например, характерная желтая линия в спектре натрия видна в спектроскоп, если пламя содержит всего одну миллиардную долю грамма натрия. Многие редкие элементы, встречающиеся в малых количествах, в том числе рубидий и цезий, были открыты только благодаря спектральному анализу.
По своим химическим свойствам щелочные металлы принадлежат к числу наиболее активных элементов. Активность щелочных металлов неодинакова и заметно увеличивается с возрастанием их порядковых номеров. Увеличение активности идет параллельно с увеличением атомных радиусов, т. е. расстояний между валентным электроном и ядром (табл. 28). Такая закономерность вполне понятна: чем дальше от ядра отодвигается валентный электрон, тем слабее становится связь между ним и ядром, тем легче он отрывается от ядра. А так как активность металлов определяется легкостью отдачи валентных электронов, то она, естественно, растет в ряду Li — Cs.
Как уже было сказано ранее (см. стр. 168), прочность связи электронов в атоме оценивается величиной энергии ионизации, или ионизационным потенциалом, элемента. Наименьшие ионизационные потенциалы имеют атомы щелочных металлов. Величины ионизационных потенциалов этих элементов характеризуются следующими цифрами (в вольтах):
Li Na К Rb Cs 5,36 5,1 4,32 4,10 3,87
Приведенные данные показывают, что при переходе от лития к цезию ионизационные потенциалы уменьшаются, следовательно, уменьшается и прочность связи наружного электрона с ядром атома.
С низкими ионизационными потенциалами связана способность щелочных металлов легко терять электроны при различных внешних воздействиях, в частности при действии света на чистую поверхность металла. На этом явлении основано действие фотоэлементов — приборов, непосредственно преобразующих световую энергию-в электрическую. Особенно чувствительным к действию света является цезий.
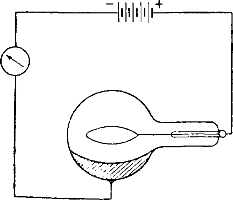
Схема устройства фотоэлемента показана на рис. 139. Стеклянный шарообразный сосуд наполовину покрыт изнутри тонким слоем одного из щелочных металлов. Над слоем металла расположено кольцо или сетка из платиновой проволоки. Колба наполнена неоном или другим инертным газом при очень малом давлении. Сетку и слой металла соединяют с внешней цепью, в которую включают батарею элементов и гальванометр. При отсутствии света цепь остается разомкнутой; ток не проходит через фотоэлемент. Но если осветить поверхность металла, то с нее начинают срываться электроны, летящие в направлении сетки и вызывающие тем самым замыкание цепи и возникновение в ней постоянного тока.
Фотоэлементы широко применяются на практике при передаче изображений на расстояние (например, телевидение), в различных сигнализационных установках, для автоматической регулировки механизмов в звуковом кино и т. п.
Все щелочные металлы энергично соединяются с кислородом.. Рубидий и цезий даже самовоспламеняются на воздухе; литий, натрий и калий загораются при небольшом нагревании. Чрезвычайно характерно, что только литий, сгорая, образует нормальный окисел Li2О, остальные же щелочные металлы превращаются в перекиси следующего состава:
Na2O2; К2O4; Rb2O4; Cs2O4
Строение перекисей типа M2O4, где М — щелочной металл, точно не установлено.
Не менее энергично, чем с кислородом, взаимодействуют щелочные металлы с галогенами, особенно с хлором и фтором.
Так как в ряду напряжений щелочные металлы стоят далеко впереди водорода, то они вытесняют водород не только из кислот,, но и из воды (где концентрация Н’-ионов очень мала), образуя, сильные основания:
2К + 2НОН = 2КОН + Н2
Легко отдавая при химических реакциях свои валентные электроны, щелочные металлы являются самыми энергичными восстановителями.
Восстановительная способность щелочных металлов настолько велика, что они могут восстанавливать даже атомы водорода,, превращая их в отрицательно заряженные ионы Н’ с электронной конфигурацией инертного газа гелия. Так, при нагревании щелочных металлов в струе водорода получаются твердые кристаллические вещества типа МН, называемые гидридами, в состав которых входит отрицательно заряженный водород:
2Na + H2 = 2Na+H—
С водой гидриды взаимодействуют с образованием водорода: и щелочи:
NaH + Н2О = NaOH + Н2
По своему химическому характеру гидриды несколько напоминают соли галогеноводородных кислот. Гидриды щелочных_ металлов растворяются в жидком аммиаке, образуя проводящие ток растворы. При электролизе таких растворов на катоде выделяется металл, а на аноде — водород; следовательно, последний находится в растворе з виде анионов Н’:
МН⇄М• + Н’
Щелочные металлы образуют большое число солей. За исключением нескольких солей лития (LiF, Li2CO3, Li3PO4), почти все соли щелочных металлов легко растворимы в воде. Поэтому, если для реакции требуется тот или иной анион, его обычно берут в виде соли щелочного металла. Растворы солей, образованных слабыми кислотами, вследствие гидролиза имеют сильно щелочную реакцию.
Щелочные металлы и их соединения широко используются в технике. Смазки, содержащие соединения лития, сохраняют высокие смазочные свойства в пределах от 120 до —60° и находят широкое применение в авиации. Небольшая добавка едкого лития увеличивает мощность щелочных электрических аккумуляторов и втрое удлиняет срок их службы. Хлористый и бромистый литий применяются в подводных лодках для очистки воздуха. Литиевые соединения входят в состав оптических стекол и т. д. Цезий и рубидий применяются для изготовления фотоэлементов. Особенно же большое практическое значение имеют натрий, калий и их соли.
Вы читаете, статья на тему Щелочные металлы в природе

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.