Соли аммония сложные неорганические соединения, которые содержат аммоний, NH4+. Они похожи на соответствующие соли натрия по своему строению, цвету и другим свойствам.
В большинстве случаев соли аммония хорошо растворимы в воде, за исключением метаванадата аммония NH4VO3 и триметаванадата аммония (NH4)3V3O9, которые полностью диссоциируются в водном растворе.
Соли аммония проявляют все общие свойства солей. При действии на них щелочей происходит выделение газообразного аммиака. Все соли аммония разлагаются при нагревания.
Что такое соли аммония
При выпаривании нейтрализованных растворов аммиака ионы аммония соединяются с анионами взятых кислот.
Образуя твердые кристаллические вещества, обладающие ионной решеткой и всеми свойствами типичных солей.
Они называются солями аммония.
Соли аммония образуются не только при нейтрализации водных растворов аммиака, но и путем непосредственного соединения газообразного аммиака с безводными кислотами.
Например:
NH3 + HCl = NH4Cl + 42 ккал
По этой причине в лаборатории, где всегда имеются в воздухе газообразный аммиак и пары кислот, стекла вытяжных шкафов, окна, склянки с реактивами и другие предметы бывают покрыты белым налетом аммониевых солей.
Свойства солей аммония
Соли аммония очень похожи на соли щелочных металлов, особенно на соли калия, так как ионы К+ и NH4+ имеют приблизительно одинаковые радиусы.
Соли аммония легко растворяются в воде, полностью распадаясь на ионы.
Растворы аммониевых солей, образованных сильными кислотами, вследствие гидролиза имеют слабокислую реакцию.
Многочисленные попытки выделить аммоний из его солей в свободном состоянии, т. е. получить вещество, состоящее из электронейтральных молекул NH4, не увенчались успехом.
Так как уже в момент образования аммоний тотчас же распадается на аммиак и водород. Свободный аммоний должен был бы обладать свойствами металла.
Амальгама аммония
Косвенным указанием на его металлический характер может служить существование амальгамы аммония — сплавa аммония со ртутью, очень похожего на амальгамы щелочных металлов.
Для получения амальгамы аммония приготовляют сперва амальгаму натрия, внося металлический натрий небольшими порциями в ртуть, пока не получится полужидкая масса.
Если к приготовленной таким образом амальгаме натрия прилить насыщенный раствор нашатыря, то аммоний вытесняется натрием из нашатыря и образует с ртутью очень объемистую, жирную на ощупь амальгаму аммония.
Амальгама аммония очень непрочна и может сохраняться только при низкой температуре.
Если амальгаму аммония привести в соприкосновение с холодным раствором сернокислой меди, то аммоний вытесняет из последней некоторое количество меди с одновременным образованием сернокислого аммония:
2NH4 + CuSO4 = Сu + (NH4)2SO4
При обыкновенной температуре амальгама аммония быстро разлагается на ртуть, аммиак и водород.
Реакция солей с щелочами
Чрезвычайно характерно отношение аммониевых солей к щелочам.
Если подействовать щелочью на водный раствор какой-нибудь аммониевой соли, то происходит следующая реакция:
NH•4 + OH’ ⇄ NH3 + Н2O
При нагревании раствора аммиак улетучивается, в чем нетрудно убедиться по запаху и по окрашиванию влажной лакмусовой бумажки.
Таким образом, присутствие любой аммониевой соли в растворе можно обнаружить, нагревая раствор со щелочью (реакция на ион аммония).
При нагревании сухих солей аммония последние довольно легко диссоциируют на аммиак и кислоту.
Примером может служить нагревание хлорида аммония, где образуется аммиак и соляная кислота, но эта реакция обратима:
NH4Cl ⇄ NH3 + HCl
Если входящая в состав соли кислота, как в данном случае, летуча, то она улетает вместе с аммиаком и при охлаждении снова соединяется с ним, образуя соль.
Например, при нагревании сухого хлористого аммония в пробирке соль как бы возгоняется, образуя белый налет на голодных стенках пробирки.
Если же кислота нелетуча, то улетает только аммиак, а кислота остается в сосуде, в котором производилось нагревание соли.
Примером может служить нагревание (NH4)4SО4, (NH4)3PО4 и др.
Образование ионов аммония
Образование ионов аммония при взаимодействии аммиака с водой и растворами кислот объясняется строением молекулы аммиака, которое может быть передано следующей формулой:
Из этой формулы видно, что, кроме трех электронов, образовавших, пары с электронами водорода, у азота остается еще «свободная» пара электронов.
За счет этой пары происходит присоединение иона водорода к азоту, после чего оба электрона становятся общими для азота и водорода.
Если ион водорода, как не имеющий ни одного электрона, изобразить в виде [Н]+, то все сказанное можно передать следующей схемой:
Аналогичным путем образуется и ион гидроксония из молекулы воды и иона [Н]+
Применение
Нитрат аммония (аммиачная селитра, аммоний азотнокислый) NH4NO3 применяют как азотные удобрения и для изготовления взрывчатых веществ — аммонитов.
Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение, получается на коксохимическом производстве.
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяются в пищевой промышленности для производства мучных кондитерских изделий в качестве химических разрыхлителей, при крашении тканей, в производстве витаминов и в медицине.
Хлорид аммония (нашатырный камень) NH4Cl используют в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии и медицине.
Амальгама аммония практического применения не нашла, связи с неустойчивостью соединения.
Быстрые ответы?
Основное применение как удобрение, а также в получении других веществ.
Основное получение действием соответствующей кислоты на аммиачный раствор, например нашатырный спирт и азотная кислота.
Все соли считаются потенциально опасными, так как например нитрат аммония сильный окислитель, и может при некоторых условиях взрываться, что стала причиной взрыва в порту Бейрута 4 августа.


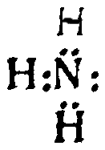
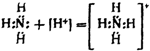
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.