История понятий окисления и восстановления
Рассматривая в свойства водорода, мы отметили, что водород может восстанавливать многие окислы, отнимая от них кислород, и противопоставили этот процесс окислению, т. е. присоединению кислорода.
Первоначально этик два понятия — окисление и восстановление—ничего другого и не выражали, как только присоединение и отнятие кислорода.
Вскоре, однако, они получили более широкое значение.
Окислением стали называть не только процесс присоединения кислорода, но и процесс отнятия от вещества водорода на том основании.
Что отнятие водорода происходит большею частью под действием кислорода (например, 4NH3 + 3О2 = 2N2 + 6Н2О).
Точно так же восстановлением стали называть не только процесс отнятия кислорода, но и процесс присоединения водорода.
Впоследствии эти понятия были еще более расширены и к процессам окисления и восстановления были отнесены многие реакции.
В которых ни кислород, ни водород участия не принимают, но которые по существу сходны с типичными реакциями окисления и восстановления.
Например, горение металлов в хлоре, броме, парах серы, а также вообще всякое присоединение металлоидов стали называть окислением:
2Аl + 3Вr2 = 2АlВr3
аналогично
4Аl + 3О2 = 2Аl2О3
2FeCl2 + Cl2 = 2FeCl3
аналогично
4FeO + О2 = 2Fe2О3
Обратное превращение АlВr3 в Аl или FeCl3 в FeCl2 получило название восстановления.
Таким образом, понятия «окисление» и «восстановление» стали несколько расплывчатыми и только электронная теория строения вещества придала им совершенно точный и определенный смысл.
Рассматривая типичные процессы окисления и восстановления с точки зрения электронной теории, нетрудно убедиться, что эти процессы всегда сопровождаются перемещением электронов от одних атомов или ионов к другим.
Причем окисляющееся вещество теряет электроны, а восстанавливающееся присоединяет их.
Приведем примеры.
Пример окисления и восстановления магний и кислород
Горение магния в кислороде:
Атом магния имеет в наружном слое два электрона.
При взаимодействии с кислородом два атома магния отдают четыре электрона молекуле (двум атомам) кислорода и превращаются в положительные двухзарядные ионы Mg++.
Последние связываются с образовавшимися ионами кислорода в кристаллы окиси магния MgO.
Таким образом, горение (окисление) магния сопровождается переходом электронов от магния к кислороду.
Восстановление окиси меди водородом
Восстановление окиси меди водородом:
В окиси меди ион меди несет два положительных заряда.
В процессе реакции электроны переходят от атомов (молекул) водорода к ионам меди.
Медь становится нейтральной, а образовавшиеся ионы водорода связываются с ионами кислорода в молекулы воды.
Отсюда видно, что восстановление окиси меди сопровождается присоединением к ней (точнее — к ионам Сu++) электронов.
Взаимодействие между хлорным железом и йодистым водородом в растворе
При смешивании растворов хлорного железа и йодистого водорода выделяется свободный иод, а хлорное железо превращается в хлористое:
Обычно говорят, что при этой реакции хлорное железо восстанавливается в хлористое, а йодистый водород окисляется до свободного иода.
Но из приведенного уравнения видно, что электроны переходят только из ионов J—к ионам Fe+++, причем последние превращаются в ионы Fe++.
А ионы J— — в нейтральные атомы иода, образующие затем молекулы J2; ионы же Сl— и Н+ в результате реакции не изменяются.
Таким образом, в действительности восстанавливается не хлорное железо в хлористое, а ионы Fe+++ в ионы Fe++, окисляется же не йодистый водород, а ионы J» в атомы иода.
В чем заключается окисления
Сущность окисления заключается в потере электронов атомами или ионами окисляющегося вещества, а сущность восстановления — в присоединении электронов к атомам или ионам восстанавливающегося вещества.
Поэтому в настоящее время всякий процесс, при котором вещество теряет электроны, называется окислением.
Наоборот, присоединение электронов рассматривается как восстановление.
Почему окисление не не может произойти без одновременного восстановления другого вещества
Окисление какого-либо вещества не может произойти без одновременного восстановления другого вещества.
Так как потеря электронов одними атомами или ионами связана с присоединением электронов к другим атомам или ионам.
Например, при горении магния в кислороде или воздухе происходит окисление магния и одновременно восстановление кислорода.
При взаимодействии водорода с окисью меди последняя (точнее, ион Сu++) восстанавливается, а водород окисляется и т. д.
Электронная теория окисления-восстановления
Таким образом, каждая реакция, сопровождающаяся перемещением электронов, является единством двух противоположных процессов — окисления и восстановления.
Вот почему в настоящее время все такие реакции принято называть окислительно-восстановительными.
Вещества, атомы или ионы которых присоединяют в процессе реакции электроны, называют окислителями, а вещества, отдающие электроны, — восстановителями.
Окислитель во время реакции отнимает электроны от окисляющегося вещества и сам при этом восстанавливается.
Наоборот, восстановитель, теряя электроны, окисляется.
Так, например, при взаимодействии хлорного железа и йодистого водорода (см. выше) окислителем является ион Fe+++.
Который, присоединяя один электрон, восстанавливается в ион Fe++, a восстановителем — ион J— отдающий один электрон и окисляющийся в атом иода.
Это можно наглядно представить, если выразить процесс окисления и процесс восстановления отдельными «электронными» уравнениями :
Описанные выше реакции получения водорода из воды и из кислот действием на них некоторых металлов тоже являются реакциями окисления-восстановления.
При всех этих реакциях атомы металлов, отдавая электроны, служат восстановителями, а ионы водорода, приобретая электроны, — окислителями.
Например, при реакции:
Следовательно, водород, который мы рассматривали раньше как восстановитель, действует в качестве окислителя, когда он находится в виде положительно заряженных ионов.
Изменение валентности
Переход электронов при окислительно-восстановительных реакциях от одних атомов или ионов к другим.
Естественно, сопровождается изменением валентности участвующих в реакции элементов.
Изменение валентности является характерным признаком, по которому сразу можно определить, является ли данная реакция окислительно-восстановительной.
Так как окисление заключается в потере электронов атомами или ионами, а восстановление — в присоединении их.
То при окислении алгебраическая величина валентности повышается (т. е. увеличивается положительная валентность или уменьшается отрицательная), при восстановлении — понижается.
В этом легко убедиться, рассмотрев в приведенных выше примерах изменение валентности окисляющихся и восстанавливающихся атомов или ионов.
Например, при взаимодействии между хлорным железом и йодистым водородом валентность железа (заряд ионов Fe+++) понижается с +3 до +2.
А валентность иода (заряд ионов J—) повышается от —1 до 0 у свободного иода и т. д.
Теория Л. В. Писаржевского
Изложенная выше теория окислительно-восстановительных: процессов разработана Л. В. Писаржевским (1874—1938).
Первым ученым, широко использовавшим электронную теорию для объяснения химических процессов.

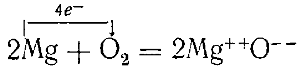
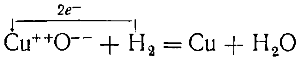
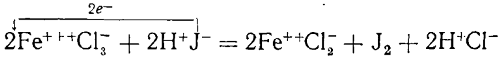
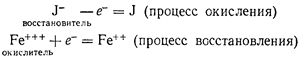
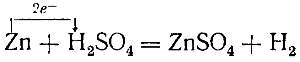
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.