Натрий это химический элемент, простое вещество, микроэлемент, формула натрия Na,
Натрий (Natrium)
Ат. вес 22,991. Как уже было указано, металлический натрий получается или электролизом расплавленного едкого натра, к которому прибавляют около 12% соды, или электролизом хлористого натрия.
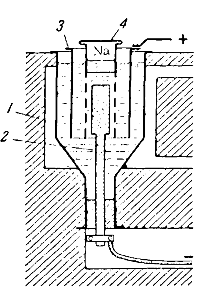
Схема установки для получения натрия из едкого натра изображена на рис. 140. Железный сосуд 1, вмещающий до 200 кг NaOH и вмазанный в печь, обогревается снаружи раскаленными газами для поддержания едкого натра в расплавленном состоянии. Катодом служит толстый никелевый или медный стержень 2, проходящий сквозь дно сосуда, анодом — никелевый цилиндр 3. Катод окружен железной сеткой, переходящей вверху в железный цилиндр 4,закрытый крышкой. Назначение сетки — предотвратить проникновение выделяющегося натрия к аноду.
В процессе электролиза расплавленный натрий накапливается внутри железного цилиндра, откуда он периодически вычерпывается и отливается в формы.
У анода вследствие разряда гидроксильных ионов выделяется кислород:
4ОН’ — 4е— = 2Н2О + О2
Образующаяся вода почти целиком испаряется, но все же некоторая часть ее разлагается током, вследствие чего у катода одновременно с натрием выделяется и водород.
Большой интерес представляет получение натрия из расплав-ленного хлористого натрия, так как в этом случае дорогостоящий едкий натр заменяется значительно более дешевым продуктом — поваренной солью.
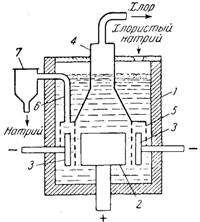
Ванна для электролиза NaCl (рис. 141) состоит из железного кожуха 1, обложенного изнутри огнеупорным кирпичом. Графитовый анод 2 окружен никелевым катодом 3, внешние стенки которого покрыты электроизоляционным материалом. Под колоколом 4 находится сетчатая перегородка 5, охватывающая катод. Металлический натрий собирается в кольцевом катодном пространстве и по трубе 6 переходит в сборник 7. Хлористый натрий загружают через отверстие в крышке ванны.
Недостатком способа является необходимость проведения процесса при сравнительно высокой температуре (610—650°), что требует довольно сложной аппаратуры.
В свободном состоянии натрий представляет собой серебристо-белый металл уд. веса 0,97, плавящийся при 97,7°. Натрий настолько мягок, что легко режется ножом. Вследствие легкой окис-ляемости на воздухе натрий хранят обычно под слоем керосина.
Металлический натрий имеет довольно широкое применение.. Он служит в качестве исходного материала при производстве перекиси натрия и амида натрия, а также используется при многих синтезах органических соединений. В лабораториях натрием часто пользуются для удаления последних следов влаги из некоторых органических растворителей.
С ртутью натрий образует твердый сплав — амальгаму натрия, которая иногда используется как восстановитель вместо чистого металла.
С кислородом натрий образует два соединения: окись натрия Na2O и перекись натрия Na2О2.
Окись натрия Na2O может быть получена путем пропускания над натрием, нагретым не выше 180°, умеренного количества кислорода или нагреванием перекиси натрия с металлическим натрием:
Na2О2 + 2Na = 2Na2O
Окись натрия бурно реагирует с водой с образованием гидроокиси натрия и выделением большого количества тепла:
Na2O + H2О = 2NaOH
Перекись натрия Na2О2 образуется при сжигании натрия на воздухе или в кислороде. В заводских условиях перекись натрия готовят путем нагревания металлического натрия в плоских алюминиевых чашках, помещенных в железную трубу, через которую пропускается ток воздуха, освобожденного от углекислого газа. Полученный продукт имеет вид желтоватого порошка и содержит около 93% Na2О2.
Перекись натрия обладает очень сильными окислительными свойствами. Многие органические вещества при соприкосновении с ней воспламеняются.
При осторожном растворении перекиси натрия в холодной воде получается раствор, содержащий едкий натр и перекись водорода. Напомним, что все перекиси рассматриваются в настоящее время как соли очень слабой кислоты — перекиси водорода. Поэтому взаимодействие перекиси натрия с водой по существу представляет собой гидролиз соли, образованной слабой кислотой и сильным основанием:
Na2O2 + 2Н2О ⇄ Н2О2 + 2NaOH O2» + 2H2O ⇄ H2O2 + 2OH’
Если нагревать полученный раствор, то вследствие разложения перекиси водорода из него выделяется кислород.
При действии на перекись натрия разбавленных кислот также получается перекись водорода:
Na2O2 + H2SO4 = Na2SO4 + Н2О2 O2»+2Н• = Н2О2
Ввиду образования перекиси водорода при растворении Na2O2 в воде или в разбавленных кислотах перекись натрия широко применяется для отбелки тканей, шерсти, шелка, соломы, перьев и т. п.
Важное значение имеет реакция взаимодействия перекиси на трия с углекислым газом:
2Na2O2 + 2СO2 = 2Na2CO3 + O2
O22— + 2e— = 2O—
O22— ─ 2e— = O2
На этой реакции основано применение перекиси натрия в изолирующих противогазах, а также в подводных лодках для поглощения выдыхаемого людьми углекислого газа и одновременного пополнения запаса кислорода в воздухе.
Гидрат окиси натрия NaOH представляет собой твердое белое, очень гигроскопическое вещество, плавящееся при 328°. Ввиду сильного разъедающего действия на ткани, кожу, бумагу и другие органические вещества он называется также едким натром («натр» старое название окиси натрия).
В воде едкий натр растворяется с выделением большого количества тепла вследствие образования различных гидратов.
Едкий натр должен храниться в хорошо закупоренных сосудах, так как он легко поглощает из воздуха углекислый газ, постепенно превращаясь в карбонат натрия.
Основным способом получения едкого натра является электролиз водного раствора поваренной соли. При пропускании тока у катода разряжаются
ионы водорода и одновременно происходит накопление гидроксильных ионов, в результате чего получается едкий натр; у анода выделяется хлор. Очень важно, чтобы продукты электролиза не смогли смешиваться, так как в противном случае едкий натр будет взаимодействовать с хлором с образованием NaCl и NaClO:
2NaOH + Сl2 = NaCl + NaClO + H2O
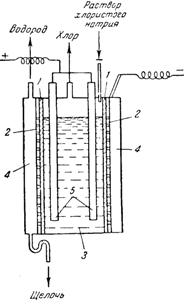
Существует несколько способов воспрепятствовать проникновению хлора в раствор едкого натра. Чаще других применяется диафрагменныйспособ, при котором анодное и катодное пространства отделены друг от друга перегородкой из асбеста. В электролитических ваннах, служащих для получения едкого натра по этому способу (рис. 142), вертикально установленная диафрагма 1, плотно прилегающая к железному дырчатому катоду 2, отделяет анодное пространство 3 от катодного 4. Анодами служат графитовые стержни 5. В процессе электролиза в анодное пространство непрерывно поступает раствор хлористого натрия, а из катодного вытекает раствор, содержащий смесь NaCl
и NaOH. При его выпаривании выкристаллизовывается хлористый натрий и остается почти чистый раствор щелочи. Последний сливают с NaCl и выпаривают до полного удаления всей воды. Полученную щелочь сплавляют и отливают в формы. Побочными продуктами при получении едкого натра являются хлор и водород.
Несколько иначе протекает электролиз раствора NaCl, если катодом служит металлическая ртуть. В этом случае у катода разряжаются не ионы водорода, а ионы натрия. Выделяющийся натрий растворяется в ртути, образуя жидкий сплав, так называемую амальгаму натрия. Горячая вода легко разлагает амальгаму, причем получается едкий натр, выделяется водород и освобождается ртуть. Таким образом, пользуясь в качестве катода ртутью, можно получать совершенно чистый едкий натр, не содержащий примеси неразложившегося хлористого натрия.
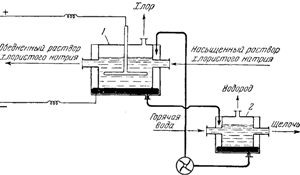
На рис. 143 показана схема установки для получения едкого натра по ртутному способу. Установка состоит из двух частей — электролизера 1, где происходит образование амальгамы натрия,
и разлагателя 2, в котором получается едкий натр и выделяется водород. На дно электролизера налит слой ртути. Насыщенный раствор хлористого натрия непрерывно поступает в электролизер с одной стороны, а обедненный раствор с меньшим содержанием NaCl выходит с другой стороны. Выделяющийся хлор отводится сверху, а амальгама натрия непрерывно перетекает в разлагатель 2, где разлагается поступающей в него горячей водой. Образующийся раствор щелочи вытекает через специальный отвод; водород удаляется через трубу вверху разлагателя. Регенерированная ртуть с помощью ртутного элеватора снова возвращается в электролизер 1.
Кроме электролитического способа получения едкого натра,, иногда еще применяется более старый способ — кипячение раствора соды с гашеной известью:
Na2CO3 + Са (ОН)2 → ↓СаСO3 + 2NaOH
По окончании реакции раствор сливают с осадка углекислого кальция и, выпарив воду, сплавляют полученный едкий натр.
Едкий натр является одним из важнейших продуктов основной химической промышленности. Ежегодная мировая (без СССР) выработка его превышает 6,5 млн. т. B продажу он поступает под названием каустической соды. Огромные количества едкого натра потребляет нефтяная промышленность, где NaOH применяется для очистки продуктов переработки нефти, мыловаренная промышленность, бумажная, текстильная, производство искусственного волокна и ряд других производств.
Производство едкого натра в СССР в 1955 г. составило 563,4 тыс. г, что более чем в 10 раз превышает выработку едкого натра в дореволюционной России. В 1959—1965 гг. производство едкого натра намечается увеличить в несколько раз по сравнению с 1955 г.
Соли натрия. Натрий образует соли со всеми известными кислотами. Так как важнейшие соли натрия и их применение были описаны при соответствующих кислотах, то здесь мы только напомним их.
NaCl — хлористый натрий, или поваренная соль . Na2S — сульфид натрия, или сернистый натрий . Na2SO4• 10Н2О — десятиводный сульфат натрия, или глауберова соль . NaNО3 — нитрат натрия, или натриевая селитра . Na2CO3 • 10Н2О — карбонат натрия, или сода . Na2SiO3— силикат натрия, или растворимое стекло. Na2S2O3 • 5Н2O — тиосульфат натрия.
Очень многие соли натрия образуют кристаллогидраты с довольно большим содержанием кристаллизационной воды.
Все соли натрия окрашивают пламя газовой горелки в желтый цвет. Реакция эта позволяет обнаруживать присутствие самых ничтожных количеств натрия в исследуемом веществе.
Вы читаете, статья на тему Натрий (Natrium)

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.