Гальванические элементы

На реакциях вытеснения одних металлов другими из растворов солей основано действие большинства гальванических элементов — приборов, служащих для превращения химической энергии в электрическую. Помимо значения этих приборов как источников получения электрического тока, в данный момент они представляют для нас интерес потому, что измерение электродвижущих сил различных элементов позволяет количественно охарактеризовать активность металлов, а следовательно, и установить порядок их расположения в ряду напряжений. Чтобы разобраться в этом вопросе, нужно предварительно познакомиться с устройством и работой гальванических элементов.
При погружении металла в раствор соли другого металла, например цинковой пластинки в раствор Pb(NО3)2, электроны переходят с атомов цинка на ионы свинца благодаря непосредственному контакту между теми и другими. Выделяющаяся при реакции химическая энергия превращается при этом в энергию тепловую. Можно, однако, осуществить взаимодействие между цинком и свинцовой солью, совершенно отделив их друг от друга, если только будет обеспечена возможность перехода электронов от цинка к ионам свинца, — единственное, что для этой реакции необходимо.
Возьмем два стакана и нальем в один из них раствор Zn(NО3)2, а в другой — раствор Рb(NO3)2. В первый раствор опустим цинковую пластинку, во второй — свинцовую. (Последняя играет только роль проводника и потому может быть заменена угольным стержнем.) Находящиеся в стаканах растворы соединим перевернутой U-образной трубкой, наполненной раствором какого-нибудь электролита, например KNO3 (рис. 125). Если теперь соединить обе пластинки металлической проволокой, то сейчас же появляется ток, направление которого показывает, что электроны перемещаются от цинка к раствору свинцовой соли. В то же время цинк начинает растворяться, а на свинцовому пластинке осаждается выделяющийся свинец.
U-образная трубка нужна для того, чтобы ионы соли могли свободно перемещаться из одного раствора в другой, иначе раствор цинковой соли, вследствие перехода в него ионов Zn•• из пластинки, зарядился бы положительно, а раствор свинцовой соли, из которого уходят ионы Рb••, приобрел бы отрицательный заряд. Оба заряда стали бы препятствовать перемещению электронов от цинка к свинцовой соли и реакция прекратилась бы. Очевидно, что по мере течения реакции отрицательные ионы направляются к цинку, а положительные — к свинцу, поддерживая электрическое равновесие в растворах.
Так, в созданных нами условиях осуществляется на расстоянии та же реакция, которая происходила раньше при простом погружении цинка в раствор свинцовой соли. Различие заключается только в том, что в первом случае электроны переходили с атомов цинка на ионы Рb•• при столкновениях последних с поверхностью цинка, поэтому движение их носило беспорядочный характер и выделяющаяся при реакции энергия превращалась в тепловую. Теперь же, устранив соприкосновение цинка с раствором свинцовой соли, мы заставляем электроны пробежать некоторый путь по проволоке, чтобы достигнуть ионов свинца, и вместо беспорядочного движения электронов получаем довольно мощный их поток, носящий название электрического тока.
Описанный нами прибор представляет собой гальванический элемент, в котором химическая энергия окислительно-восстановительной реакции преобразуется в электрическую. Его отрицательным электродом является цинк, положительным — свинец. У отрицательного электрода происходит окисление цинка:
Zn — 2е— = Zn••
у положительного — восстановление ионов свинца:
Pb•• +2е— = Pb
Сложив эти два уравнения, получаем общее уравнение происходящей в элементе реакции:
Zn + Pb•• = Pb + Zn••
или в молекулярной форме
Zn + Pb(NO3)2 = Zn(NO3)2+Рb
Подобно описанному строятся и другие гальванические элементы. В них всегда отрицательным электродом служит более активный металл, который отдает свои электроны ионам менее активного металла, превращая их в нейтральные атомы. В процессе работы элемента отрицательный электрод постепенно разрушается вследствие перехода его вещества в раствор в виде ионов.
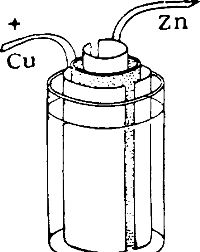
На рис. 126 изображен хорошо известный из курса физики медно-цинковый элемент, состоящий из медной и цинковой пластинок, погруженных в растворы соответствующих сульфатов. Раствор сульфата цинка налит в пористый глиняный цилиндр, вставленный в стеклянную банку с раствором сульфата меди. Пористая перегородка предохраняет растворы от перемешивания, позволяя в то же время ионам перемещаться из раствора в раствор, когда элемент дает ток.
При работе элемента происходит следующая реакция:
Zn + Сu•• = Сu + Zn••
Иногда в гальванических элементах используется реакция вытеснения водорода из кислоты цинком:
Zn + 2H• = Zn•• + H2
Первый гальванический элемент, изобретенный итальянским физиком Вольта, состоял из цинковой и медной пластинок, погруженных в раствор серной кислоты. При соединении пластинок такого элемента проволокой электроны перемещаются от цинка к меди, а с нее переходят на находящиеся в растворе ионы водорода, разряжая их. Поэтому водород выделяется у медной пластинки, а не у цинковой.
Вы читаете, статья на тему Гальванические элементы

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.