Так же как инертные газы составляют основу периодической таблицы, самый простой атом — атом водорода — дает ключ, который открывает доступ в эту систему.
Атомы любого другого элемента «подражают» атому водорода. Для того чтобы убедиться, что это действительно так, мы должны исследовать взаимодействие атомов водорода со светом.
Свет, испускаемый (или поглощаемый) атомами водорода, называется спектром атомарного водорода. Этот спектр позволяет лучше понять сущность периодической таблицы.
Свет как вид энергии
Прежде чем анализировать спектр атома водорода, необходимо более подробно изучить свойства обычного света.
Свет — это вид энергии.
Формулировка «свет — это вид энергии» согласуется с любыми самыми обычными экспериментами.
Многие из вас, сфокусировав лучи света линзой на бумаге, поджигали ее.
На этом принципе основано действие солнечных батарей, с помощью которых достигаются температуры в несколько тысяч градусов и могут быть расплавлены самые тугоплавкие материалы.
Повышение температуры бумаги или тугоплавкого материала называется поглощением света.
Повышение температуры означает, что поглощается энергия, которая переносится светом.
Нам не нужна линза для того, чтобы «почувствовать» энергию световых лучей. Вспомните жаркие летние дни, яркое солнце и исходящее от него тепло.
Такое удовольствие мы испытываем вследствие поглощения энергии нашим телом.
При сильном перегреве можно получить ожоги, которые вызываются химическими реакциями, протекающими под влиянием энергии солнечных лучей.
Здесь у нас есть полное основание утверждать, что свет несет энергию.
В качестве другого хорошо известного доказательства рассмотрим фотосинтез. Вы, несомненно, много раз слышали, что фотосинтез — это химический процесс, при котором растения «накапливают» солнечную энергию. О химических реакциях фотосинтеза многое известно.
Действительно, в результате этих реакций образуются химические соединения с более высоким теплосодержанием, чем у исходных веществ.
Эти реакции не идут в отсутствие света: свет поставляет энергию, необходимую перевода реагирующих веществ в продукты реакции с более высоким теплосодержанием.
Свет распространяется импульсами. Каждый импульс, называемый фотоном, содержит количество энергии, определяемое частотой.
Это положение выражается известным уравнением:
E = hv (1)
Величина h называется постоянной Планка. Эта постоянная — просто коэффициент пересчета, с помощью которого частота выражается в единицах энергии.
Экспериментальные данные, которые привели к уравнению (1), имеют удивительную—историю, о которой вы услышите при прохождении курса физики.
Нас же интересует применение этого уравнения для объяснения спектра атомарного водорода. Этот спектр содержит частоты, испускаемые атомом водорода.
Затем, пользуясь уравнением (1), по спектру можно получить сведения об энергии, которой обладает атом водорода.
Свет, испускаемый атомом водорода
Часть лучей света, испускаемого источником, проходит через узкую щель и фокусируется в пучок линзой.
Затем этот пучок лучей преломляется призмой.
Спектр, или состав света по частотам, регистрируется на фотопленке.
При введении газообразного водорода в разрядную трубку и приложении высокого напряжения излучается свет.
Кажется, что появляется яркий красный свет, но с помощью спектрографа обнаруживаются поразительные факты.
Вместо почти сплошного потемнения (как это было в случае раскаленной вольфрамовой проволоки) на фотопленке появляется ряд линий.
Каждая линия соответствует определенной частоте, испускаемой атомами водорода.
Интервалы между каждыми двумя линиями на пленке соответствуют областям частот, в которых атомы водорода не испускают свет.
Сразу же выявляются две особенности спектра атомарного водорода, полученного с помощью разрядной трубки, которые были известны ученым еще в 1840 г.
- Атомы водорода отличаются от всех других атомов по частотам, которые они испускают. В спектре наблюдаются лишь строго определенные частоты.
- Частоты, соответствующие линиям на фотопленке, располагаются с определенными интервалами.
В спектре различаются две группы линий — одна в видимой области спектра, а другая в ультрафиолетовой.
В каждой группе наблюдаться постепенно уменьшение интервалов между последующими линиями с увеличением частоты.
Уровни энергии атома водорода
Ученые выводили дискретную шкалу энергии атома водорода по спектру точно так же, как это делали мы.
Конечно, обычно для обозначения всех понятий используют более научный язык.
Например, значения энергии, которой обладает атом, указывают на вертикальной шкале и называют уровнями энергии.
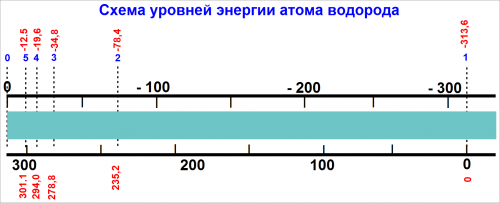
На рис. представлена схема уровней энергии атома водорода. Каждый уровень энергии характеризуется целым числом n, причем самый низкий уровень имеет n = 1.
На рис. показаны две шкалы энергии. Слева находится шкала, на которой энергия для уровня n = 1 равна нулю.
На этой шкале уровни энергии соответствуют нашему коромыслу весов с засечками. Шкала, расположенная справа, смещена вверх, и уровень n — 1 соответствует отрицательной энергии, равной —313,6 ккал.
Нуль смещен вверх на эту величину так, что нулевое значение энергии на этой шкале соответствует засечке «бесконечность».
Очевидно, расположение уровней энергии не зависит от такого произвольного выбора нуля энергии, поэтому можно пользоваться любой шкалой.
По причинам, которые будут изложены ниже в этой главе, правая шкала более удобна и применяется гораздо чаще.
Квантовая механика и атом водорода
До появления квантовой механики спектр атома водорода казался необъяснимым. Чтобы проследить, как разрешалась эта проблема, вернемся на пятьдесят-шестьдесят лет назад. Это очень интересный пример, показывающий прогресс науки.
К 1912 г. было известно, что атом водорода состоит из-протона и электрона. Эти две частицы притягиваются друг к другу в результате взаимодействия их электрических зарядов.
Физики были уверены, что со временем можно будет вычислить свойства такой системы. Действительно, законы движения макроскопических тел уже были известны в течение столетий.
Поведение электрически заряженных частиц также было достаточно хорошо изучено на макроскопическом уровне.
Несмотря на это, ученые не могли объяснить, почему существует атом водорода, не говоря уже о том, почему он имеет вполне определенные значения энергии.
Действительно, законы выведенные для макроскопических тел, утверждают (хотя на самом деле это не так), что атом, содержащий ядро, неустойчив и что электрон должен упасть на ядро.
На этом этапе развития науки датский физик Нильс Бор решил пересмотреть все эти данные заново.
При этом он учел тот факт, что объяснение основано на выявлении сходства исследуемой системы и хорошо изученной модели.
Объяснение нельзя считать убедительным, пока не будет строго доказано это сходство.
Нильс Бор предположил, что механические и электрические свойства макроскопических тел не являются входящей моделью для атома водорода.
Он приступил к поиску новой модели, которая не противоречила бы известным фактам.
Нильс Бор начал с предположения, что строение атома (расположение электронов вокруг его ядра) определяется его энергией.
В соответствии с фактами Бор предположил, что могут существовать лишь определенные расположения электронов, которые он назвал «устойчивыми состояниями».
Каждое такое состояние характеризуется определенной энергией, и, поскольку существует ряд электронных конфигураций, ему должен соответствовать ряд определенных энергий.
Таким образом, Нильс Бор отказался от старых моделей атома (принятых в классической физике), которые допускали электронные конфигурации, соответствующие всем возможным значениям энергии.
Очевидно, самое устойчивое состояние атома — это то, в котором атом обладает минимальной энергией.
Бор рассуждал так: поскольку существование атома, содержащего ядро, точно установлено, этот факт должен быть положен в основу утверждения, что атом может существовать бесконечно долгое время в своем наиболее устойчивом состоянии.
Хотя этот факт в то время нельзя было объяснить (напомним, что по законам классической физики атом должен разрушиться — электрон должен упасть на ядро), его следовало признать, так как он был выявлен в результате экспериментов.
Бор предположил также, что, хотя состояние с минимальной энергией наиболее устойчиво, атом может переходить в возбужденные состояния с более высокой разрешенной энергией (при поглощении света или при сильном столкновении с другими атомами или электронами).
Возбужденный атом не остается долго в этом состоянии; он теряет избыточную энергию в виде света.
Поскольку существуют определенные уровни энергии, могут происходить только определенные изменения энергии.
Изменение энергии атома должно быть равно энергии испускаемого света в соответствии с уравнением (2)
E2 — E1 = hv
Следовательно, частота испускаемого атомом света целиком определяется разрешенными для данного атома значениями энергии его электронов.
Взгляды Бора были настолько необычны, что не были тогда приняты. Пришлось согласиться с тем, что Бор сумел найти метод точного расчета уровней энергии для атома водорода.
В последующие десять лет метод расчета Бора был полностью заменен более совершенными методами, но его постулат, что для атома возможны состояния лишь с определенной энергией, был неоднократно подтвержден.
В этом разделе мы привели пример, позволяющий судить о том, как развивается наука.
На основании широкой применимости законов классической механики и электродинамики ученые, естественно, решили, что эти же законы без изменения можно применить и к атому.
По существу это было экстраполяцией, так как законы были выведены для макроскопических тел.
Но, с другой стороны, если законы, описывающие движение планет, описывают и движение теннисного мяча, то почему бы их не применить к движению электронов?
Многие экспериментальные факты отрицали возможность этого, но физики надеялись, что будет найден путь для объяснения этих фактов в рамках известных (и казавшихся неопровержимыми).
Законов Хотя Бор в конце концов отказался от традиционных представлений, он все же в какой-то мере руководствовался ими, предлагая произвести только те изменения, которые были необходимы для объяснения противоречивых фактов.
Вероятно, наиболее примечательно то, что основным оружием Бора в борьбе за его теорию был точный математический расчет уровней энергии атома водорода, хотя его модель теперь отвергается полностью.
Модель, которой он пользовался, соответствовала только атому водорода и не подходила ни к одному другому атому.
Однако не стоит иронизировать по поводу этого примера.
Вы можете быть уверены, что некоторые из тех теорий, которые приведены в этой книге, по мере накопления наших знаний о природе будут отброшены как устаревшие.
И не препятствием, а стимулом к дальнейшим открытиям является то, что мы не знаем, какая теория окажется устаревшей.
Атом водорода и квантовые числа
Современная теория явлений атомного масштаба, называемая квантовой механикой, была разработана несколькими исследователями в 1925— 1927 гг.
Для нас наиболее важным положением квантовомеханической теории является то, что движение электрона происходит по «разрешенным» орбитам и описывается квантовыми числами.
Квантовыми числами являются целые числа, которые определяют устойчивые состояния атома.
Понятие орбита означает пространственное описание движения электрона, соответствующее определенному устойчивому состоянию.
Главное квантовое число n
Эти номера, принятые за определенные характеристики, являются «квантовыми числами» коромысла весов.
Плавные кривые наводят на мысль, это энергию можно удобно выразить математически через квантовое число n.
Если использовать правую шкалу рис., то мы видим, что для любого значения n энергия Е всегда отрицательна.
При увеличении n энергия возрастает и приближается к нулю на шкале.
Исследование истинных значений энергии показывает, что уровни энергии, представленные на рис., точно определяются числом n в соответствии с уравнением:
Еn = — (313,6/n2) ккал/моль (4)
где Еn — уровень энергии с квантовым числом n; n — целое число, равное 1, 2, 3, … , ∞.
Число n называется главным квантовым числом.
Математическое выражение (4) является одним из соотношений, полученных Бором.
С помощью современных квантовомеханических методов, конечно, тоже можно получить это выражение, но на основе модели, которая во многом не согласуется с моделью Бора.
Орбиты и главное квантовое число
В квантовой механике на математической основе выводится выражение:
Еn = — (313,6/n2) ккал/моль.
Кроме того, для атома водорода квантовая механика детально описывает, как движется электрон вокруг ядра, но не дает точной траектории его движения.
Единственное, что можно сделать, — это предсказать вероятность нахождения электрона в данной точке пространства.
Эта вероятность, рассмотренная в течение определенного промежутка времени, представляет «усредненную» картину поведения электрона.
Такое описание движения электрона как раз и является тем, что мы называем орбитой.
Представление о движении электрона по орбите содержит такую же информацию, как и та, которую мы можем получить при рассмотрении мишени для стрельбы из лука.
После многократной стрельбы по мишени распределение отверстий на ней показывает, насколько удачно выступали в соревнованиях стрелки.
Вблизи яблока мишени имеется много отверстий, но по мере удаления от него число отверстий на квадратный сантиметр мишени постоянно уменьшается.
На любом заданном расстоянии от яблока мишени «плотность» пробитых отверстий (число попаданий на квадратный сантиметр) определяет вероятность того, что следующая стрела попадет именно в это место.
Мы видим, что по отверстиям в мишени можно судить только о вероятности попадания данной стрелы в определенное место от яблока мишени, а не о последовательности появления на ней этих отверстий.
В случае распределения электронов орбита показывает нам вероятность нахождения электрона на определенном расстоянии от ядра.
По ней ничего нельзя сказать о том, как движется электрон от точки к точке, т. е. о его траектории.
Хотя квантовая механика не определяет траекторию электрона, она дает сведения об изменении орбиты с увеличением n.
Она также показывает, что для каждого значения n имеется n2 различных орбит. Для атома водорода все n2 орбит для данного значения п. имеют одинаковую энергию:
-(316,6/n2)ккал/моль.
s-Орбиты
Рассмотрим самый низкий уровень энергии атома водорода, n = 1. Как мы только что узнали, должно быть nг уровней с этой энергией; поскольку n — 1, уровень будет лишь один.
Это соответствует тому, что электрон находится в пространстве вокруг ядра, обладающем сферической симметрией.
Такую орбиту называют 1 s-орбитой, а электрон, перемещающийся по этой орбите, — s-электроном.
В символе 1s цифра 1 означает, что n = 1, а буква s — что орбита сферически симметрична (s — начальная буква слова spherical = сферический).
Термин «сферическая симметрия» и строение s-орбиты (рис. 15-8) следует усвоить очень хорошо.
Они показывают, что если мы хотим определить положение электрона где-то на поверхности сферы данного радиуса r1 которая имеет в центре ядро.
То вероятность нахождения электрона в какой-либо точке этой сферы точно такая же, как и вероятность нахождения его в любой другой точке сферы радиуса r1.
Это же справедливо и для другого радиуса, r2, но вероятность нахождения электрона где-то на поверхности сферы этого радиуса иная, чем для сферы радиуса r1.
Возможность нахождения электрона в какой-либо точке зависит от радиуса сферы.
1s-Электрон можно обнаружить в пространстве около ядра на большом расстоянии, но с наибольшей вероятностью — на расстоянии приблизительно 10-8 см от ядра.
Следующий уровень энергии соответствует n = 2. Согласно нашему правилу, для n = 2 имеется n2 = 22 = 4 различных пространственных расположения орбит с одинаковой энергией — 313,6/4 = —78,4 ккаль/моль.
Одна из них, которая тоже имеет сферическую симметрию, и называется 2s-орбитой.
Мы получили рамный результат: более высокая энергия 2s-электрона позволяет ему более длительное время находиться на большом расстоянии от ядра.
Для каждого значения n существует лишь одна сферически симметричная орбита. С увеличением электрон, находящийся на n— и s-орбите, в среднем все больше удаляется от ядра.
р-Орбиты
Главному квантовому числу n = 1 соответствует лишь одна орбита — 1 s-орбита. Для n = 2 возможны уже четыре пространственных расположения электронов.
Одно из них — 2s-орбиту — мы уже описали. Остальные три называются 2р-орбитами. Электрон на р-орбите ведет себя так, что он находится предпочтительно в одной из двух областей, расположенных по разные стороны от ядра.
При движении р-электрона создается пространственное расположение, по форме похожее на гантель.
Ось этой гантели можно расположить вдоль одной из трех взаимно перпендикулярных осей координат.
Поскольку имеются три оси координат, р-орбит тоже три, причем ось каждой из них перпендикулярна двум другим.
Иногда их обозначают как рх-, ру— и рz-орбиты, что подчеркивает их пространственный характер.
рх-Орбита концентрируется в направлении оси х.
т. е. px-электрон с большей вероятностью находится вблизи оси х, чем где-либо еще. С другой стороны, ру-орбита сконцентрирована вдоль оси у.
Эти пространственные характеристики полезны при объяснении геометрических свойств молекул. На рис. 15-9 показано распределение электронов на 2р-орбитах.
Каждый уровень энергии с п больше единицы имеет три р-орбиты. С увеличением n электрон в среднем занимает n р-орбит, расположенных на больших расстояниях от ядра, но направление по осям, показанное на рис. 15-9, всегда сохраняется.
Орбиты d и f. Теперь мы можем построить новую диаграмме уровней энергии атома водорода, включив все, что мы знаем об электронных орбитах.
Данному значению и соответствует n2 орбит.
Для n = 3 существует 32 = 9 орбит, т. е. на пять больше, чем сумма одной 3s— и трех 3р-орбит.
Эти пять орбит, называемые d-орбитами, имеют более сложное пространственное расположение, чем р-орбиты.
В части таблицы, относящейся к атому водорода, приведены числа 2, 8, 18 и 32 — т. е. те же числа, которые определяют особую устойчивость электронных конфигураций атомов инертных газов.
Нужно только умножить n2 на два — важный фактор, который нельзя было предвидеть.
Кроме того, необходимо будет найти объяснение существования разности в восемь электронов у неона и аргона, а также разности в восемнадцать электронов у криптона и ксенона.
Тем не менее положено начало объяснению периодической таблицы.
Можно рассмотреть химические свойства первых десяти элементов, используя для объяснения орбиты атома водорода и принимая следующие два предположения:
- 1. Атомы этих элементов имеют орбиты и уровни энергии, которые качественно идентичны орбитам и уровням энергии атома водорода.
- 2. На каждой орбите любого элемента может находиться не больше двух электронов.
Первое предположение следует из аналогий, отмеченных в таблице, и подтверждается многочисленными данными, полученными при изучении спектров этих атомов.
Второе предположение обусловлено множителем 2, указанным в последней колонке таблицы.
Таблица устойчивые электронные конфигурации и атом водорода
| Инертные газы | Атом водорода | ||||
| элемент | число электронов | разность чисел электронов | n | число орбит n1 | 2n2 |
| Гелий | 2 | 2 | 1 | 1 | 2 |
| Неон | 10 | 10 — 2 = 8 | 2 | 4 | 8 |
| Аргон | 18 | 18 — 10= 8 | 3 | 9 | 18 |
| Криптон | 36 | 36 — 18= 18 | 4 | 16 | 32 |
| Ксенон | 54 | 54 — 36 = 18 | |||
| Радон | 86 | 86 — 54 = 32 | |||
Сделав эти два предположения, мы можем предложить для каждого атома электронную конфигурацию с минимальной энергией.
Для этого мы мысленно разместим электроны последовательно на свободных орбитах с минимальной энергией.
Орбита электрона с минимальной энергией — это 1s-орбита.
Единственный электрон атома водорода занимает эту орбиту. В атоме гелия имеются два электрона, и заряд ядра — два.
Поскольку на каждой орбите могут находиться два электрона, оба электрона атома гелия располагаются на 1s-орбите.
Образующаяся электронная конфигурация обозначается 1s2 — это показывает, что на 1s-орбите находятся два электрона.
Символ 1s2 называется электронной конфигурацией.
Теперь посмотрим, что происходит с тремя электронами, расположенными вокруг ядра с зарядом три, как в атоме лития.
Первые два из трех электронов занимают орбиту с минимальной энергией — 1s-орбиту.
Когда на орбите находятся два электрона, она целиком заполнена в соответствии с нашим вторым предположением.
Все остальные электроны должны располагаться на орбитах с более высокой энергией.
Следовательно, третий электрон в атоме лития занимает 2s-орбиту, и конфигурацию электронов мы запишем как 1s22s1.
Несмотря на то что заряд ядра атома лития равен трем, этот последний электрон связан с ядром гораздо слабее.
Так как 2s-электрон в атоме лития большую часть времени находится дальше от ядра, чем 1s-электроны.
Атом лития легко отдает этот электрон, образуя ион Li+, что является характерным свойством всех щелочных металлов.
Атом бериллия имеет на один электрон больше, чем атом лития. Четвертый электрон, входящий в состав атома бериллия, может занимать 2s-орбиту, образуя при этом конфигурацию 1s22s2.
Два 2s-электрона будут удаляться легче других электронов, в результате чего образуется ион Ве2+.
На 2s-орбите уже нет места для пятого электрона, который появляется у атома следующего элемента — бора.
Однако существуют другие орбиты с главным квантовым числом 2.
Этот пятый электрон занимает 2р-орбиту, образуя конфигурацию 1s22s22p1.
Если мы будем продолжать рассматривать последующие элементы, то получим такие конфигурации атомов углерода, азота, кислорода, фтора и неона:
| Атом углерода | 1s22s22p1/x2p1/y |
| Атом азота | 1s22s22p1/x2p1/y2p1/z |
| Атом кислорода | 1s22s22p2/x2p1/y2p1/z |
| Атом фтора | 1s22s22p2/x2p2/y2p1/z |
| Атом неона | 1s22s22p2/x2p2/y2p2/z |
При переходе к следующему элементу, атому натрия, мы вынуждены использовать орбиту со следующим более высоким квантовым числом:
Атом натрия 1s2 2s22p2/x2p2/y2p2/z 3s1
Снова появляется электрон, который большую часть времени находится дальше от ядра, чем любой другой электрон.
Атом натрия легко отдает этот один электрон, в результате чего образуется ион Na+, т. е. рассматриваемый элемент по химическим свойствам сходен с литием.