Теория:
Валентность и степень окисления углерода (C) — это способность элемента образовывать химические связи и приобретать соответствующий условный заряд в соединениях.
Углерод — это неметалл из IV группы, который наглядно демонстрирует, как переменная основная валентность приводит к широчайшему диапазону степеней окисления.
Его уникальность — в способности образовывать устойчивые цепи атомов и множественные связи.
Валентность углерода не является абсолютно фиксированной, хотя его максимум всегда IV.
V = IV (Четыре): Это основная валентность (например, в CH4, CO2). Углерод образует четыре связи.
V = II (Две): Это редкая валентность (например, в угарном газе CO).
Степень окисления углерода переменна и зависит от того, с чем он связан.
Диапазон СО Углерода является самым широким среди всех элементов: от -4 до +4.
СО = +4: Проявляется в соединениях с наиболее электроотрицательными элементами (например, в CO2, CCl4), где углерод отдает четыре электрона.
Зависимость степени окисления от валентности
Для углерода (C) зависимость между численным значением степени окисления (СО) и валентности (V) прямая в максимальных значениях, но крайне переменная в целом.
Являясь неметаллом IV группы, способен как отдавать, так и принимать электроны, но его особенность — способность к образованию множественных связей и устойчивых цепей (основа органической химии).
Его электронная конфигурация — 1s22s22p2. На внешнем уровне находится 4 электрона.
Углерод может отдать, принять или обобществить все четыре электрона.
Валентность углерода (чаще всего IV, реже II) создает структурную основу — она определяет количество связей (четыре в большинстве случаев, как в CH4 или CO2).
Степень окисления (-4 до +4) реализует эту возможность в виде условного заряда, который зависит от соседа Углерода:
Если C связан с более электроотрицательными неметаллами (как O или F), он отдает электроны, и его СО становится положительной (до +4).
Если C связан с менее электроотрицательными элементами (как H или металлы в карбидах), он принимает электроны, и его СО становится отрицательной (до -4).
Таким образом, численное значение валентности (IV) совпадает с максимальными численными значениями СО (±4).
Однако, в отличие от Бора, Углерод может иметь любое промежуточное СО (например, -3, -2, -1, 0, +1, +2, +3) в органических соединениях.
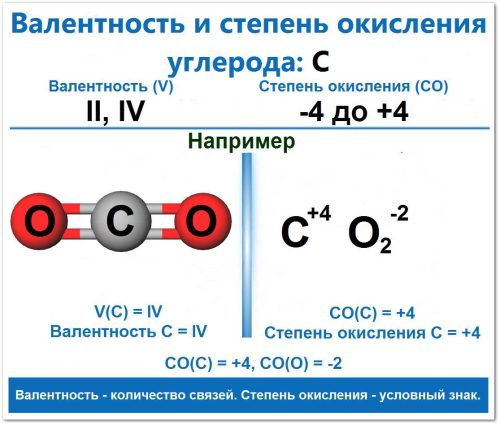
Пример: в CO2 (углекислый газ) V = IV и СО = +4; в CH4 (метан) V = IV и СО = -4.
Валентность (V) углерода
Валентность Углерода (то есть, число химических связей, которые он может образовать) в подавляющем большинстве его соединений постоянна и равна IV (четырем).
Но также часто встречается и II (две).
Это обусловлено тем, что атом Углерода находится в IV группе и имеет четыре внешних электрона (2s2 2p2).
Для достижения стабильного состояния (октета) он всегда стремится использовать все эти четыре электрона для образования именно четырех связей.
➡️ Валентность IV (Четыре)
Используются четыре внешних электрона для формирования четырех связей.
Это основная валентность Углерода.
Четыре одинарные связи:
Пример: В углекислом газе (CO2). Углерод связан с двумя атомами кислорода двумя двойными связями (O = C = O).
Одна тройная и одна одинарная связь:
Пример: В этине (ацетилене, C2H2). Один атом углерода связан с другим тройной связью (H—C≡C—H).
➡️ Исключение: Валентность II (Две)
Углерод может проявлять валентность II в специфических случаях, когда он не полностью использует все свои внешние электроны.
Пример: В угарном газе (CO). Углерод связан с одним атомом кислорода, используя только две ковалентные связи (одна из которых является донорно-акцепторной).
Валентность Углерода, таким образом, в большинстве его соединений равна IV (четырем), что делает его фундаментальным элементом органической химии, но может быть и II (двум).
Степень окисления (СО) углерода
Степень окисления показывает условный заряд атома, предполагая ионные связи.
Углерод, будучи чистым неметаллом, обладает средней электроотрицательностью, что позволяет его СО принимать широчайший диапазон значений — от -4 до +4.
Пример: CO2 (Углекислый газ)
Рассмотрим, как определяется максимальная положительная СО Углерода в CO2:
Кислород (O): Является более электроотрицательным элементом, чем C. В большинстве оксидов он всегда принимает два электрона. СО(O) = -2
Углерод (C): Так как O более электроотрицателен, чем C, Углерод отдает четыре электрона, чтобы компенсировать два атома O (так как (+4) + 2 × (-2) = 0). СО(C) = +4
✅ Обозначение
Показатель степени окисления над формулой:
C+4O2-2
Гибкость и Диапазон СО Углерода
Степень окисления Углерода (условный заряд) не связана напрямую с его валентностью, которая чаще всего равна IV.
Благодаря его средней электроотрицательности, СО всегда переменна.
Углерод является неметаллом, который может как отдавать, так и принимать электроны в зависимости от соседа, что обеспечивает ему диапазон от -4 до +4.
➡️ СО = +4: Максимальное положительное состояние
Это максимальное положительное состояние СО углерода, которое возникает, когда C связан с более электроотрицательными неметаллами (O, F, Cl).
Углерод условно отдает свои четыре валентных электрона.
➡️ СО = -4: Максимальное отрицательное состояние
Это максимальное отрицательное состояние, которое возникает, когда C связан с менее электроотрицательным Водородом или Металлами (карбиды).
Углерод выступает в роли принимающего электроны.
Таким образом, для целей химии диапазон от -4 до +4 отражает истинную химическую гибкость Углерода.
Валентность и степень окисления на примере
➡️ Валентность (V) Углерода в CO
Валентность показывает общее число связей.
Молекула CO имеет очень прочную связь, которая состоит из двух ковалентных связей и одной донорно-акцепторной связи (за счет неподеленной электронной пары Кислорода).
V(C) = III (Три) Атом Углерода (C) образует три связи с атомом Кислорода (O) — одна из которых является донорно-акцепторной.
V(O) = III (Три) Атом Кислорода (O) также проявляет валентность III.
➡️ Степень окисления (СО) углерода в CO
Степень окисления показывает условный заряд (куда смещены электроны). Кислород более электроотрицателен, чем Углерод.
Кислород (O): В оксидах его СО почти всегда -2. СО(O) = -2
Углерод (C): Определяется из условия нейтральности (СО(C) + СО(O) = 0): СО(C) + (-2) = 0, следовательно СО(C) = +2
➡️ Вывод: Расхождение V и СО в оксиде углерода CO
Наблюдается расхождение:
Валентность Углерода (V) = III
Степень Окисления Углерода (СО) = +2
Пример решения, задача:
▶️ Дано:
Соединение углекислый газ (CО2).
⌕ Найти:
Определите валентность (V) и степень окисления (СО) углерода в соединении.
✨ Решение:
Валентность (V).
В молекуле CO2 (структура O=C=O) Углерод образует две двойные связи, а Кислород — две.
- V(C) = IV (Четыре связи)
- V(O) = II (Две связи)
Степень окисления (СО)
Степень окисления Кислорода в оксидах всегда -2. Сумма СО должна быть равна нулю.
СО(O) = -2
СО(C) + 2 × СО(O) = 0
СО(C) + 2 × (-2) = 0 → СО(C) = +4
✅ Ответ:
Его валентность равна IV, степень окисления +4.
Часто задаваемые вопросы:
Валентность (V): IV (два), и широкий диапазон (СО) от -4, +4..
Наиболее стабильным состоянием с точки зрения степени окисления является СО = 0.
Чаще всего (V) IV (четыре), реже II (два), (СО) -4 до +4 (зависит от соседа).