Почему кислород окислитель
В общей характеристике этой подгруппы отмечается, что все атомы её элементов во внешнем слое имеют по шесть электронов.
Поэтому у них, хотя несколько в меньшей степени, чем у галогенов, находящихся в тех же периодах, выражена тенденция принимать электроны, а именно по два электрона, т. е. у них ярко выражена окислительная способность.
В подгруппе галогенов самым сильным окислителем является верхний член её — фтор, так как и здесь самым сильным окислителем является кислород.
Электроны внешнего слоя у атомов кислорода находятся ближе к ядру, чем у атомов остальных элементов шестой группы.
Поэтому кислород во всех реакциях, только принимает по два электрона во внешний слой и становится двухвалентным со знаком минус, т. е. он во всех реакциях является окислителем.
Электроны внешнего слоя у атомов серы находятся дальше от ядра, чем у атомов кислорода.
Поэтому атомы серы могут не только принимать по два электрона, т. е. быть окислителями, но они и отдают электроны из внешнего слоя, т. е. могут быть восстановителями.
Рис.2. Кислород окислитель. Горение натрия. Горение угля. Горение железа в кислороде
Окислительные свойства с веществами
При повторении способов получения кислорода из его химических соединений, как то:
1. Из бертолетовой соли,
2. Марганцовокислого калия,
3. Окиси ртути, воды
и других веществ, отмечается, что во всех этих реакциях кислород окисляется.
То при повторении кислорода необходимо особо отметить его окислительные свойства в атомарном состоянии.
В связи со свойствами атомарного кислорода изучаются и резко выраженные окислительные свойства озона, разлагающегося по уравнению:
О3 = О2 + О.
При повторении водородных соединений кислорода опять отмечается окислительное свойство перекиси водорода.
При повторении реакций соединения серы с водородом и металлами, подчёркивается исключительно окислительная роль атомов серы.
При получении соединений серы с кислородом обращается внимание на схемы строения атомов этих элементов, на сходную электронную структуру их внешней оболочки и выясняется, почему при соединении кислорода с серой последняя играет роль восстановителя.
При изучении сернистого газа, сернистой кислоты и её солей подчёркиваются преимущественно восстановительные свойства этих соединений.
Необходимо остановить внимание учащихся на промышленных способах получения серной кислоты и происходящих при этом окислительно-восстановительных реакциях.
Очень полезно, если представится возможность, совершить экскурсию на завод по производству серной кислоты и в химическом кружке сделать потом модель завода.
Следует на конкретных примерах рассмотреть окислительные свойства разбавленной и концентрированной серной кислоты.
Разбираются уравнения реакций:
Как в первой, так и во второй реакции цинк окисляется.
Но в разбавленной серной кислоте окислителями оказываются ионы водорода, а в концентрированной — ионы серы.
Статья на тему Кислород окислитель



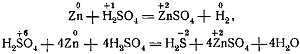
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.