Алюминий как восстановитель и как окислитель
Значение алюминия в промышленности и бытовой жизни огромно. Если по значению в этих областях на первое место поставить железо, то второе место, несомненно, будет принадлежать алюминию.
Если получать железо, олово, медь и другие металлы из руд человечество научилось в глубокой древности, то алюминий можно назвать «юным» металлом: в металлическом виде он был получен только в 1827 г. (Вёлер) по окислительно-восстановительной реакции:
AlCl3 + 3K = Аl + 3КСl.
Впоследствии этот способ восстановления алюминия заменой калия более дешёвым натрием был приложен к техническому производству алюминия (А. Сент-Клэр-Девилль, 1854 г.).
Но всё же полученный и по этой окислительно-восстановительной реакции алюминий расценивался дороже золота.
На всемирной выставке в Париже в 1855 г. был выставлен, как диковинка, слиток «серебра из глины» — алюминий, и 1 кг его в то время расценивался примерно в 1200 руб.
В 1859 г. русский учёный Н. Н. Бекетов, на основе установленного им ряда активности металлов, открыл новый способ восстановления алюминия из его фтористых соединений металлическим магнием:
По этому способу успешно стали получать алюминий зарубежные заводы (Руан, Бремен). Косные же промышленники царской России не сумели использовать этот вклад русского учёного в науку и промышленность.
Но всё же алюминий продолжал быть дорогим; в 1888 г. Дмитрию Ивановичу Менделееву в Лондоне поднесли в качестве ценного подарка кубок, сделанный из алюминия.
С 1886 г. в промышленность стал внедряться современный, электролитический метод получения алюминия.
Научные основы электрометаллургии алюминия были разработаны русским учёным П. П. Федотовым и изложены в его замечательном труде — «Экспериментальное исследование по электрометаллургии алюминия».
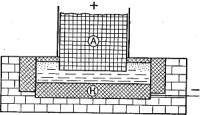
На рис. схематически изображена электрическая печь для выплавки алюминия.
Она состоит из железного ящика, внутренние стенки которого и дно выложены теплоизолирующим слоем из огнеупорных материалов и поверх него — толстой угольной обкладкой К, служащей катодом.
В качестве анода служит массивный угольный электрод А. Ящик наполняют смесью окиси алюминия, получаемой путём прокаливания и очистки природного боксита, с криолитом.
2AlF3 + 3Mg = 2 Al + 3MgF2.
Добавление криолита необходимо для понижения температуры плавления, так как чистая окись алюминия весьма тугоплавка.
При включении электрического тока прежде всего плавится криолит и в нём уже растворяется окись алюминия, которая и подвергается электролизу.
На катоде происходит восстановление алюминия:
Al••• + 3ē= Аl0.
Выделяющийся кислород образует с углем анода окись углерода и углекислый газ. Анод, вследствие его сгорания, приходится постепенно опускать вниз.
В связи с внедрением в промышленность электролитического метода получения алюминия начинает развиваться бурными темпами его добыча.
При обыкновенной температуре алюминий на воздухе покрывается очень плотной плёнкой окисла, предохраняющей металл от дальнейшего окисления.
Снятие этого слоя, например, путём амальгамирования алюминия вызывает его быстрое окисление.
По отношению к воде алюминий практически достаточно устойчив.
В разбавленных соляной и серной кислотах алюминий растворяется. Напротив, концентрированные HNO3 и H2SO4 на алюминий почти не действуют.
Так, например, холодная азотная кислота не только не растворяет алюминий, но делает его «пассивным», т. е. нерастворимым уже и в вышеуказанных разбавленных кислотах.
Алюминий легко растворим в сильных щелочах (NaOH, КОН):
2Аl + 2NaOH + 2Н2О = 3Н2 + 2NaAlO2.
Вышеприведённую реакцию можно представить так:
2Аl + 2NaOH + 6Н2O = 3Н2 + 2Na[Al(OH)4].
При изучении алюминотермии, имеющей большое народнохозяйственное и оборонное значение, следует особо подчеркнуть, что в основе этой реакции лежат исследования проф. Н. Н. Бекетова по вытеснению алюминием других металлов из их соединений.
Только в течение первых десяти лет XX столетия реакция Бекетова нашла около 50000 случаев применения.
Алюминиевая сварка
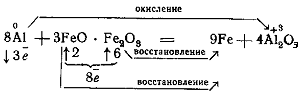
Алюминий как восстановитель применяется в термите это смесь магнитной окиси железа с алюминием.
Он с успехом применяется для сваривания железных предметов, например трамвайных рельсов.
Место стыка рельсов окружают кожухом и вливают в него из тигля полученное при помощи термита железо.
Вследствие высокой температуры концы рельсов размягчаются и свариваются жидким железом.
При горении термита происходит реакция:
Термитная зажигательная авиабомба горит ярким пламенем желтоватого оттенка в выделением небольшого количества лёгкого дыма.
Горение небольшой бомбы продолжается 3—5 минут.
Электронно-термитная бомба (электронсплав содержит 95—98% магния и немного алюминия, марганца и других металлов) горит ослепительно беловато-голубоватым пламенем.
Выделяя белый тяжёлый дым, который покрывает всё место горения белым налётом, при взрыве она разбрасывает осколки в радиусе 3—5 метров.
Мы сравнительно подробно остановились на изучении темы «Алюминий» со стороны окислительно-восстановительных реакций на том основании, что изделия из алюминия: кастрюли, тарелки, чашки, ложки, вилки, корыта, тазы, чудо-печки и т. п. — широко вошли в быт жителей города и деревни.
В условиях городской бытовой жизни, а ещё чаще в условиях деревенской жизни алюминиевая посуда быстро разрушается при варке в ней щёлока из золы, при нагревании раствора углекислой соды и т. п.
Сведения по алюминию следует расширить и углубить в химическом кружке школы, включив, например, в программу его темы полу исследовательского характера:
1) Коррозия алюминия в растворах едкого натра при разных его концентрациях и температурах;
2) Коррозия алюминия в растворе углекислой соды при разных её концентрациях;
3) Коррозия алюминия в щёлоке из золы растений при разных его концентрациях и температурах.
Статья на тему Алюминий как восстановитель и окислитель


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.