Теория:
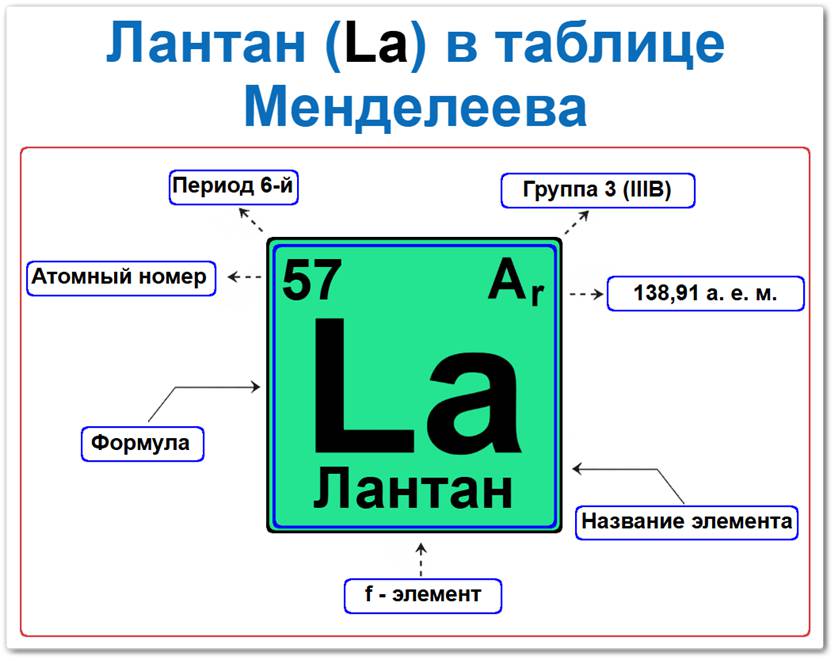
Лантан (La) в периодической системе: 6‑й период, 3‑я группа (по устаревшей классификации — III B), атомная масса 138,9 а.е.м.
Занимает положение в 6‑м периоде, открывая собой семейство лантаноидов — группу редкоземельных металлов, которые во многом повторяют его свойства.
Будучи родоначальником большой группы f-элементов, он является «эталоном» для редкоземельных металлов, расположенных в нижней части таблицы.
Нахождение Лантана в 3‑й группе и отсутствие электронов на f-подуровне (в отличие от его последователей) обуславливают его ключевые параметры:
Наиболее характерную валентность III.
А также высокую химическую активность, способность поглощать водород и использоваться в производстве современных аккумуляторов и оптических линз.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 5d1 6s2.
На которой наглядно можно определить его положение как переходного элемента, стоящего в самом начале f-блока.
Внимание:«Лантан открывает f‑блок периодической системы и относится к лантаноидам (f‑элементам).
Хотя в нейтральном атоме его 4f‑орбиталь пуста ([Xe] 5d1 6s2), его химические свойства и положение в таблице однозначно определяют его как f‑элемент».
Лантан в таблице Менделеева можно определить на основании закона периодичности: положение в 6 периоде, группа III / Лантаноиды, а также по его порядковому номеру (Z = 57).
Как определить положение Лантана в Таблице Менделеева
Локация лантана в системе описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (3-я группа, начало семейства лантаноидов).
- Период (горизонтальный ряд).
- Электронное семейство (лантан — d‑элемент, формально открывающий f-серию).
Порядковый номер / атомный номер (Z = 57)
- Служит уникальным кодом элемента в системе.
- В ядре — 57 протонов; в нейтральной оболочке — 57 электронов.
- Электронное строение: [Xe] 5d1 6s2.
Важно: Лантан не имеет электронов на 4f-подуровне, что делает его более стабильным и химически активным по сравнению с другими редкоземельными металлами.
Название и символ
- Название: «лантан» (от греч. «lanthano» — скрываюсь).
- Символ: La.
- Примечание: Был обнаружен Карлом Мозандером в 1839 году как «скрытая» примесь в цериевой земле.
Группа (3 / III B)
Расположен в 3‑й группе. Лантан является «старшим» элементом для 14 последующих лантаноидов, которые часто выносятся отдельной строкой под таблицей.
Химический потенциал:
- Валентность лантана: единственная и типичная валентность III.
- Степень окисления: +3. Оксид лантана широко применяется в производстве высококачественного оптического стекла.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Химическая активность: Лантан активно реагирует с водой, образуя гидроксид, и быстро тускнеет на воздухе.
- Водородные технологии: Обладает уникальной способностью впитывать водород (в 400 раз больше своего объема), что делает его незаменимым в никель-металлгидридных аккумуляторах.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(La) ≈ 138,905 а.е.м.
- Определение: среднее значение массы природных изотопов, основным из которых является стабильный Лантан-139.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Лантан (La, Z = 57) — элемент, открывающий семейство лантаноидов. В нейтральном атоме его электронная конфигурация [Xe] 5d¹ 6s² (4f‑орбиталь пуста), что формально сближает его с d‑элементами.
Тем не менее, в периодической системе он размещён в f‑блоке, поскольку:
- химически ведёт себя как типичный лантаноид (основная степень окисления +3);
- структурно открывает ряд элементов с заполнением 4f‑подуровня;
- его ионный радиус и координационная химия соответствуют лантаноидам.
Специфика положения: Промежуточное положение между d‑ и f‑блоками обуславливает исключительную электроположительность лантана и усиление металлических свойств по сравнению с типичными d‑переходами.
Определение энергетических уровней Лантана по Таблице Менделеева
Положение Лантана (La) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Лантана 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Лантана — 57. Его 57 электронов распределены по уровням следующим образом:
La ) 2 ) 8 ) 18 ) 18 ) 9 ) 2
3. 3-я группа (Химический характер)
Лантан — активный редкоземельный металл.
- f-элемент: Относится к f‑блоку, несмотря на электронную конфигурацию [Xe] 5d1 6s2 (4f‑орбиталь пуста). Это обусловлено его химической аналогией с лантаноидами и структурной ролью как первого элемента f‑блока.
- Место в блоке: Стоит перед церием, открывая ряд лантаноидов.
Проверка знаний: Как определить лантан по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Лантан (La) в структуре таблицы.
Показать верные ответы и пояснения
Часто задаваемые вопросы:
Лантан расположен в 6-м периоде. Относится к 3-й группе, являясь первым представителем редкоземельных металлов — лантаноидов. Его атомный номер — 57.
Поскольку лантан находится в 6 периоде, у него 6 энергетических уровней.
Он является «отцом» семейства лантаноидов и обладает способностью сильно менять свойства стекла, делая его идеальным для объективов фотоаппаратов и микроскопов.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.