Теория:
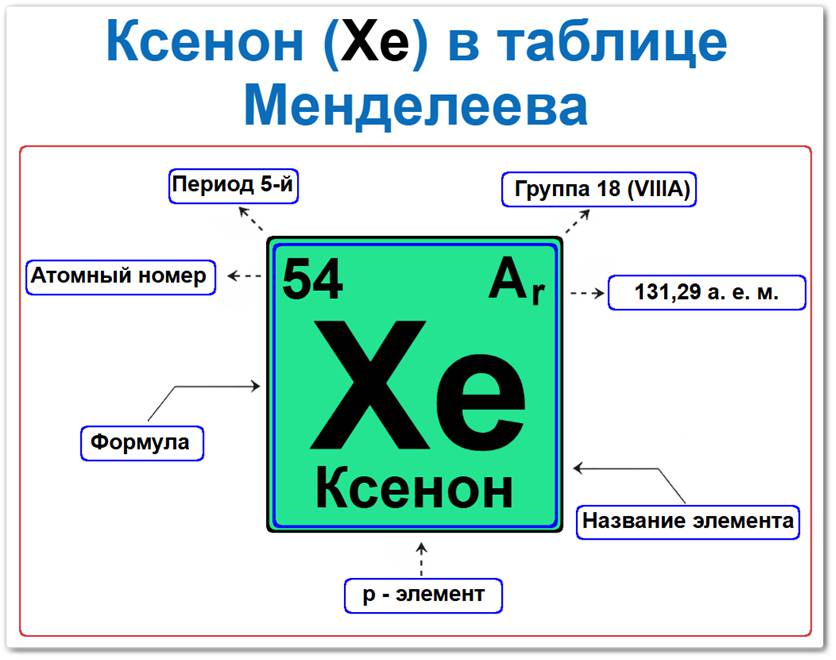
Ксенон (Xe) в периодической системе: 5‑й период, 18‑я группа (по устаревшей классификации — VIII A), атомная масса 131,29 а.е.м.
Занимает положение в конце 5‑го периода, что определяет его принадлежность к благородным (инертным) газам — элементам, известным своей химической стабильностью и использованием в осветительной технике.
Будучи химическим аналогом криптона и радона, он входит в состав группы p-элементов с полностью завершенной внешней электронной оболочкой.
Нахождение Ксенона в 18‑й группе и специфическое строение атома обуславливают его ключевые параметры:
Валентность 0 (в обычных условиях), а также способность при определенных обстоятельствах проявлять валентности II, IV, VI и VIII.
А также широкое применение в производстве мощных ксеноновых ламп, лазеров и в качестве современного наркоза в медицине.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Kr] 4d10 5s2 5p6.
На которой наглядно можно определить его положение как p-блочного элемента, где полностью заполнен 5p-подуровнь.
Ксенон в таблице Менделеева можно определить на основании закона периодичности: положение в группе инертных газов (период 5, группа 18), а также по его порядковому номеру (Z = 54).
Как определить положение Ксенона в Таблице Менделеева
Локация ксенона в системе описывается характеристиками его атомного ядра — его «химическим паспортом»:
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (18-я группа, благородные газы).
- Период (горизонтальный ряд).
- Электронное семейство (ксенон — p‑элемент).
Порядковый номер / атомный номер (Z = 54)
- Служит уникальным кодом элемента в системе.
- В ядре — 54 протона; в нейтральной оболочке — 54 электрона.
- Электронное строение: [Kr] 4d10 5s2 5p6.
Важно: Полностью заполненная внешняя оболочка (8 электронов) делает ксенон крайне инертным, однако это был первый благородный газ, для которого удалось получить настоящие химические соединения.
Название и символ
- Название: «ксенон» (от греч. «xenos» — чужой, странный).
- Символ: Xe.
Примечание: Открыт Уильямом Рамзаем и Моррисом Траверсом в 1898 году как труднодоступная примесь к воздуху
Группа (18 / VIII A)
Расположен в 18‑й группе. Это семейство инертных газов, элементы которых отличаются низкой реакционной способностью.
Химический потенциал:
- Степени окисления: Ксенон может образовывать фториды и оксиды со степенями окисления +2, +4, +6 и +8.
- Валентность ксенона: основную валентность, равную 0.
- Особенности: Фториды ксенона являются мощными окислителями.
Период (5‑й)
Находится в 5‑м периоде — его электроны распределены по пяти энергетическим уровням.
Влияние на свойства:
- Физическое состояние: Ксенон — бесцветный газ без запаха и вкуса, значительно тяжелее воздуха.
- Спектр излучения: При электрическом разряде ксенон дает яркое голубоватое свечение, похожее на дневной свет.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Xe) ≈ 131,29 а.е.м.
- Определение: среднее значение массы природных изотопов, которых у ксенона девять.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является 5p‑подуровнь (5p6).
Специфика блока: Будучи p-элементом конца периода, ксенон завершает застройку внешнего электронного слоя, что объясняет его стабильность.
Определение энергетических уровней Ксенона по Таблице Менделеева
Положение Ксенона (Xe) в системе Менделеева — это ключ к его строению.
1. 5-й период (Количество уровней)
Номер периода указывает на количество электронных слоев.
- Итог: У Ксенона 5 энергетических уровней.
2. Распределение электронов
Атомный номер Ксенона — 54. Его 54 электрона распределены следующим образом:
Xe ) 2 ) 8 ) 18 ) 18 ) 8
3. 18-я группа (Химический характер)
Ксенон — типичный представитель благородных газов.
- Стабильность: Наличие октета (8 электронов) на внешнем уровне делает его малоактивным.
- Место в блоке: Находится между криптоном и радоном.
Проверка знаний: Как определить ксенон по таблице Менделеева
Выберите три верных тезиса, которые характеризуют Ксенон (Xe).
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 54. Определяет количество протонов и электронов.
- 2) Благородный газ. Расположен в 18-й группе.
- 3) 5-й период. Имеет 5 энергетических уровней.
- 4) Ошибка. Ксенон — неметалл (газ).
- 5) Ошибка. В 1-й группе щелочные металлы.
- 6) Ошибка. Лантаноиды — это f-элементы 6-го периода.
Часто задаваемые вопросы:
Ксенон расположен в 5-м периоде. Относится к 18-й группе (благородные газы). Порядковый номер — 54.
У его атома 5 электронных уровней.
Название происходит от греческого «ксенос» (чужой), так как он был найден как крайне редкий и необычный компонент воздуха.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.