Теория:
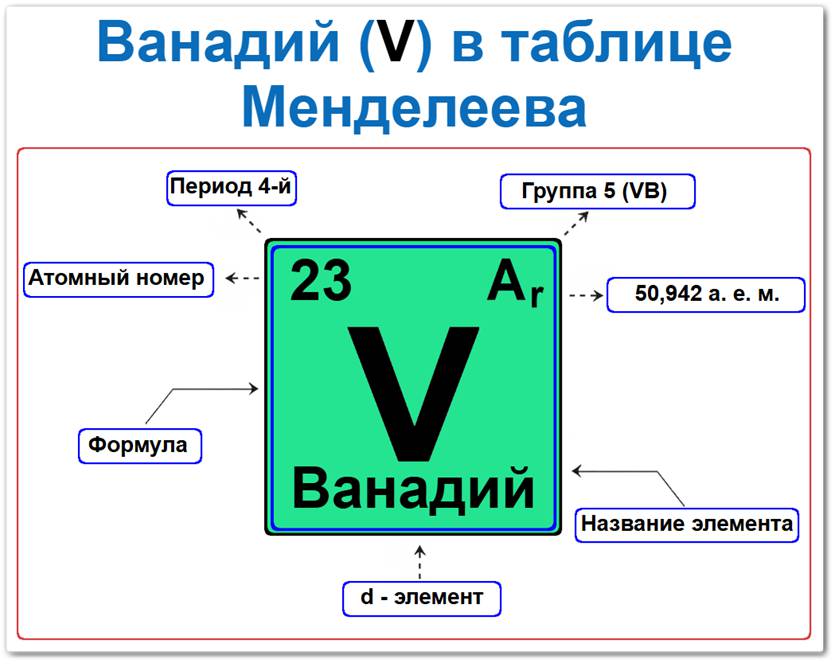
Ванадий (V) в периодической системе: 4‑й период, 5‑я группа (по устаревшей классификации — V B), атомная масса 50,9415 а.е.м.
Занимает положение в 4‑м периоде, что определяет его принадлежность к переходным металлам первого d-ряда.
Ванадий редко встречается в природе в чистом виде, обычно он рассеян в различных минералах и рудах (например, в ванадините).
Будучи химическим элементом d-блока, он располагается в левой центральной части таблицы Менделеева, открывая подгруппу элементов, в которую также входят ниобий и тантал.
Нахождение Ванадия в 5‑й группе и наличие трех неспаренных электронов на d-подуровне обуславливают его ключевые параметры:
Переменную валентность от II до V (наиболее устойчивая — V).
А также широкое применение в металлургии для создания сверхпрочных сплавов (ванадиевая сталь), в химической промышленности как катализатор (V2O5) и в производстве современных аккумуляторов.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Ar] 3d3 4s2.
На которой наглядно можно определить его положение как d-блочного элемента, находящегося в начале заполнения 3d-подуровня.
Ванадий элемент таблицы Менделеева который можно определить на основании закона периодичности: положение в ряду переходных металлов период 4, группа 5, а также по его порядковому номеру (Z = 23).
Как определить положение Ванадия в Таблице Менделеева
Локация ванадия в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (5-я группа, подгруппа ванадия).
- Период (горизонтальный ряд).
- Электронное семейство (ванадий — d‑элемент).
Порядковый номер / атомный номер (Z = 23)
- Служит уникальным кодом элемента в системе.
- В ядре — 23 протона; в нейтральной оболочке — 23 электрона.
- Электронное строение: [Ar] 3d3 4s2.
Важно: Наличие вакантных мест на d-орбитали позволяет ванадию легко менять степени окисления, что делает его соединения исключительно яркими и разнообразными по цвету.
Название и символ
- Название: «ванадий» (в честь скандинавской богини красоты Ванадис из-за красивой окраски его соединений).
- Символ: V.
- Примечание: Элемент был открыт дважды: Андресом дель Рио в 1801 году и заново Нильсом Сефстрёмом в 1830 году. Это стальной-серый, очень твердый металл.
Группа (5 / V B)
Расположен в 5‑й группе. В периодической системе ванадий находится в одной вертикальной колонке с ниобием (снизу) и танталом (побочная подгруппа V группы).
Химический потенциал:
- Валентность ванадия: переменная валентность II, III, IV, V.
- Степень окисления: от -1 до +5. Самая высокая и типичная — +5. Соединения ванадия в высших степенях окисления проявляют свойства сильных окислителей.
Период (4‑й)
Находится в 4‑м периоде — его электроны распределены по четырем энергетическим уровням.
Влияние на свойства:
- Химическая активность: При комнатной температуре ванадий пассивен, устойчив к коррозии, воде и щелочам, но реагирует с сильными кислотами-окислителями.
- Техническое значение: Добавление всего 0,1% ванадия в сталь делает её ударопрочной и устойчивой к истиранию.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(V) ≈ 50,9415 а.е.м.
- Определение: среднее значение массы природных изотопов, из которых почти 100% составляет стабильный изотоп Ванадий-51.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Идет активное заполнение 3d‑подуровня (3d3).
Специфика блока: Как типичный переходный d-металл, ванадий образует сложные комплексные соединения и интенсивно окрашенные оксиды и соли (синие, зеленые, желтые, фиолетовые).
Определение энергетических уровней Ванадия по Таблице Менделеева
Положение Ванадия (V) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 4-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Ванадия 4 энергетических уровня.
2. Список «жильцов» (Распределение электронов)
Атомный номер Ванадия — 23. Его 23 электрона распределены по уровням следующим образом:
V ) 2 ) 8 ) 11 ) 2
3. 5-я группа (Химический характер)
Ванадий — элемент побочной подгруппы V группы (или 5-й группы).
- d-элемент: Относится к переходным металлам начала периода.
- Металлические свойства: Тугоплавкий, ковкий, обладает высокой коррозийной стойкостью.
Проверка знаний: Как определить ванадий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Ванадий (V) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 23. Соответствует количеству протонов в ядре.
- 2) 4-й период, 5-й группа. Его координаты в системе.
- 3) d-элемент. Электронное семейство, определяющее металлические свойства.
- 4) Ошибка. Галогены — это 17-я группа (фтор, хлор и др.).
- 5) Ошибка. Ванадий — твердый тугоплавкий металл.
- 6) Ошибка. Ванадий относится к d-семейству переходных металлов.
Часто задаваемые вопросы:
Ванадий расположен в 4-м периоде, 5-й группе. Его порядковый номер — 23.
У ванадия 4 энергетических уровня.
Электронная схема: 2, 8, 11, 2.
Ванадий является d-элементом. В его атоме происходит заполнение предвнешнего d-подуровня.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.