Теория:
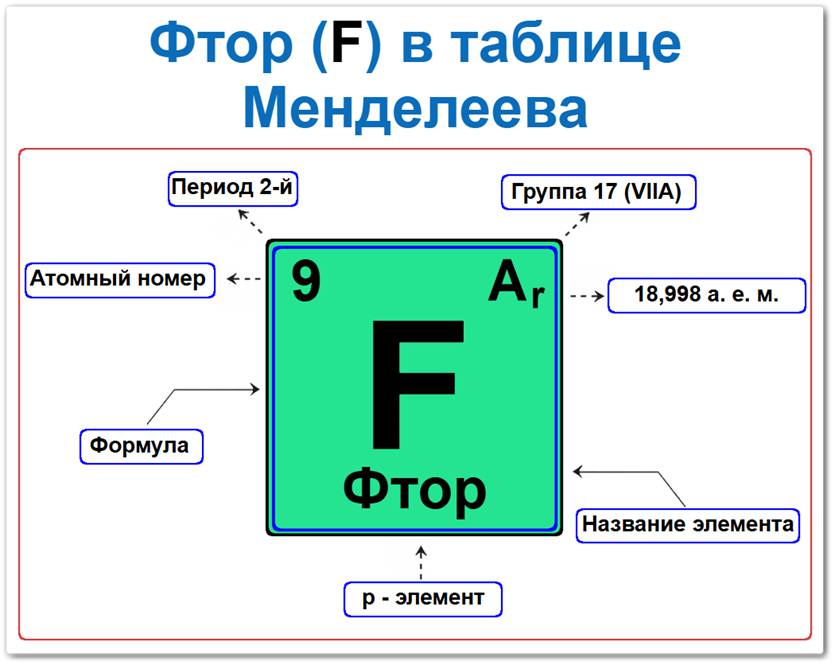
Фтор (F) в периодической системе: 2‑й период, 17‑я группа (по устаревшей классификации — VII A), атомная масса 18,998 а.е.м.
Занимает положение во 2‑м периоде, что определяет его принадлежность к p-элементам и группе галогенов.
Фтор — самый активный неметалл и самый сильный окислитель во всей таблице Менделеева.
В чистом виде из-за экстремальной реакционной способности не встречается; в природе находится в составе минералов, таких как флюорит (плавиковый шпат).
Будучи химическим элементом p-блока, он располагается в верхней правой части таблицы Менделеева, находясь над хлором и являясь «главой» семейства галогенов.
Нахождение Фтора в 17‑й группе и наличие семи валентных электронов на внешнем уровне обуславливают его ключевые параметры:
Постоянную валентность I.
А также уникальное применение в ядерной энергетике, производстве тефлона (антипригарные покрытия), в стоматологии (фторирование эмали) и холодильной промышленности (фреоны).
Структура атома подтверждается его электронной формулой (конфигурацией):
1s2 2s2 2p5 (или [He] 2s2 2p5).
На которой наглядно можно определить его положение как p-блочного элемента, которому не хватает всего одного электрона до завершения внешнего уровня.
Фтор элемент таблицы Менделеева который можно определить на основании закона периодичности: положение в ряду галогенов период 2, группа 17, а также по его порядковому номеру (Z = 9).
Как определить положение Фтора в Таблице Менделеева
Локация фтора в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (17-я группа, подгруппа галогенов).
- Период (горизонтальный ряд).
- Электронное семейство (фтор — p‑элемент).
Порядковый номер / атомный номер (Z = 9)
- Служит уникальным кодом элемента в системе.
- В ядре — 9 протонов; в нейтральной оболочке — 9 электронов.
- Электронное строение: 2, 7.
Важно: Для мастера фтор прежде всего ассоциируется с тефлоном (фторопластом). Этот материал обладает самым низким коэффициентом трения. В справочниках по ремонту фторопластовые ленты (ФУМ) рекомендуются как лучшее средство для герметизации резьбовых соединений.
Название и символ
- Название: «фтор» (от др.-греч. phthoros — «разрушение», что подчеркивает его агрессивность).
- Символ: F (Fluorum).
- Примечание: При нормальных условиях это светло-желтый газ с резким запахом, напоминающим хлор или озон. Он настолько химически «жадный», что в его атмосфере горит даже вода и песок.
Группа (17 / VII A)
Расположен в 17‑й группе. В периодической системе фтор стоит во главе колонки галогенов, находясь над хлором (Cl) и бромом (Br), и относится к (подгруппе галогенов).
Химический потенциал:
- Валентность фтора: всегда только I (самый стабильный в этом плане элемент).
- Степень окисления: всегда -1 (за исключением свободного состояния F2, где она 0). Фтор никогда не отдает свои электроны другим элементам.
Период (2‑й)
Находится во 2‑м периоде — его электроны распределены по двум энергетическим уровням.
Влияние на свойства:
- Химическая активность: Малый радиус атома позволяет ядру фтора очень сильно притягивать чужие электроны, что делает его самым «свирепым» неметаллом.
- Техническое значение: Плавиковая кислота (HF), получаемая из соединений фтора, — одна из немногих, способных растворять (травить) стекло.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Period).
Относительная атомная масса (Ar)
- Ar(F) ≈ 18,9984 а.е.м.
- Определение: В природе фтор состоит на 100% из одного стабильного изотопа — Фтор-19.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Заполняется внешний 2p‑подуровень (2p5).
Специфика блока: Будучи самым электроотрицательным элементом, фтор образует соединения почти со всеми веществами, включая даже некоторые благородные газы (например, ксенон).
Определение энергетических уровней Фтора по Таблице Менделеева
Положение Фтора (F) четко указывает на простоту и мощь его строения.
1. 2-й период (Количество этажей)
- Итог: У Фтора всего 2 энергетических уровня.
2. Список «жильцов» (Распределение электронов)
Атомный номер Фтора — 9. Его 9 электронов распределены по уровням следующим образом:
F ) 2 ) 7
3. 17-я группа (Химический характер)
- p-элемент: Относится к типичным неметаллам.
- Металлические свойства: Полностью отсутствуют; является эталонным неметаллом-окислителем.
Проверка знаний: Как определить фтор по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Фтор (F) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 9. Соответствует количеству протонов в ядре.
- 2) 2-й период, 17-я группа. Точные координаты галогена.
- 3) Электроотрицательность. Способность сильнее всех притягивать электроны.
- 4) Ошибка. Металлы находятся слева, а фтор — справа.
- 5) Ошибка. Фтор — это газ.
Часто задаваемые вопросы:
Фтор расположен во 2-м периоде, 17-й группе. Порядковый номер — 9.
У фтора 7 валентных электронов на внешнем уровне.
Его ядро находится очень близко к внешним электронам, что позволяет ему с огромной силой захватывать недостающий восьмой электрон у любых соседей.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.