Теория:
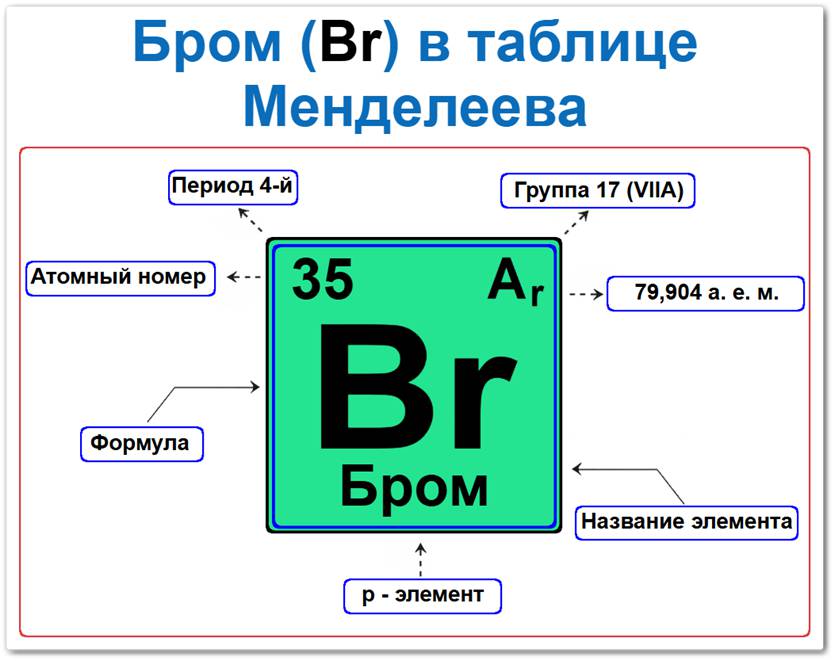
Бром (Br) в периодической системе: 4-й период, 17-я группа (по устаревшей классификации — VII A), атомная масса 79,904 а.е.м.
Занимает положение в 4-м периоде, что определяет его принадлежность к неметаллам и : период, группа, масса.
Бром — один из двух элементов (наряду со ртутью), который при комнатной температуре является жидкостью.
В природе он встречается преимущественно в виде солей в морской воде и соляных озерах.
Будучи типичным неметаллом, он входит в состав p-элементов, располагаясь в правой части таблицы Менделеева.
Нахождение Брома в 17-й группе и наличие семи электронов на внешнем слое обуславливают его ключевые параметры:
Высокую электроотрицательность и переменную валентность (I, III, V, VII).
А также широкое применение в производстве лекарственных средств, антипиренов (веществ, замедляющих горение) и в фотографии.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Ar] 3d10 4s2 4p5.
На которой наглядно можно определить его положение как p-блочного элемента, которому не хватает всего одного электрона до завершения внешнего уровня.
Бром элемент таблицы Менделеева который можно определить на основании закона периодичности: положение в ряду галогенов, период 4, группа 17, а также по его порядковому номеру (Z = 35).
Как определить положение Брома в Таблице Менделеева
Локация брома в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (17-я группа, семейство галогенов).
- Период (горизонтальный ряд).
- Электронное семейство (бром — p-элемент).
Порядковый номер / атомный номер (Z = 35)
- Служит уникальным кодом элемента в системе.
- В ядре — 35 протонов; в нейтральной оболочке — 35 электронов.
- Электронное строение: [Ar] 3d10 4s2 4p5.
Важно: Наличие пяти электронов на 4p-подуровне делает бром чрезвычайно активным окислителем, способным энергично реагировать почти со всеми металлами.
Название и символ
- Название: «бром» (от греч. «bromos» — зловонный).
- Символ: Br.
- Примечание: Открыт Антуаном Жеромом Баларом в 1826 году. В чистом виде — тяжелая жидкость красно-бурого цвета с резким неприятным запахом.
Группа (17 / VII A)
Расположен в 17-й группе. В периодической системе бром находится в одной вертикальной колонке с фтором и хлором (сверху) и иодом (снизу).
Химический потенциал:
- Валентность брома: в соединениях с водородом и металлами — I, в кислородных соединениях — до VII.
- Степень окисления: от -1 до +7. Пары брома очень токсичны и вызывают сильные ожоги при попадании на кожу.
Период (4-й)
Находится в 4-м периоде — его электроны распределены по четырем энергетическим уровням.
Влияние на свойства:
- Химическая активность: Бром менее активен, чем хлор, но более активен, чем иод.
- Физическое состояние: Увеличение атомного радиуса по сравнению с хлором приводит к тому, что при нормальных условиях это жидкость, а не газ.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Br) ≈ 79,904 а.е.м.
- Определение: среднее значение массы природных изотопов, которых у брома два стабильных: 79 и 81 (примерно в равных пропорциях).
Все значения для всех элементов можно узнать в таблице атомных масс.
p-Элемент (электронное семейство)
Идет заполнение 4p-подуровня (4p5).
Специфика блока: Как p-элемент и галоген, бром стремится принять один электрон для достижения устойчивой конфигурации благородного газа (криптона).
Определение энергетических уровней Брома по Таблице Менделеева
Положение Брома (Br) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 4-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Брома 4 энергетических уровня.
2. Список «жильцов» (Распределение электронов)
Атомный номер Брома — 35. Его 35 электронов распределены по уровням следующим образом:
Br ) 2 ) 8 ) 18 ) 7
3. 17-я группа (Химический характер)
Бром — элемент главной подгруппы VII группы (или 17-й группы).
- p-элемент: Относится к неметаллам-галогенам.
- Окислительные свойства: Проявляет сильные окислительные свойства, активно образует соли (бромиды).
Проверка знаний: Как определить бром по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Бром (Br) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 35. Указывает на количество протонов в ядре.
- 2) 4-й период, 17-я группа. Точные координаты брома как галогена.
- 3) p-элемент. Электронное семейство, определяющее его химию.
- 4) Ошибка. Бром — единственная неметаллическая жидкость при стандартных условиях.
- 5) Ошибка. Бром находится значительно ниже, в 4-м периоде.
- 6) Ошибка. Инертные газы находятся в 18-й группе; бром же химически крайне активен.
Часто задаваемые вопросы:
Бром расположен в 4-м периоде, 17-й группе. Его порядковый номер — 35.
У брома 4 энергетических уровня.
Электронная схема: 2, 8, 18, 7.
Бром является p-элементом. Его внешние p-орбитали содержат 5 электронов.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.