Теория:
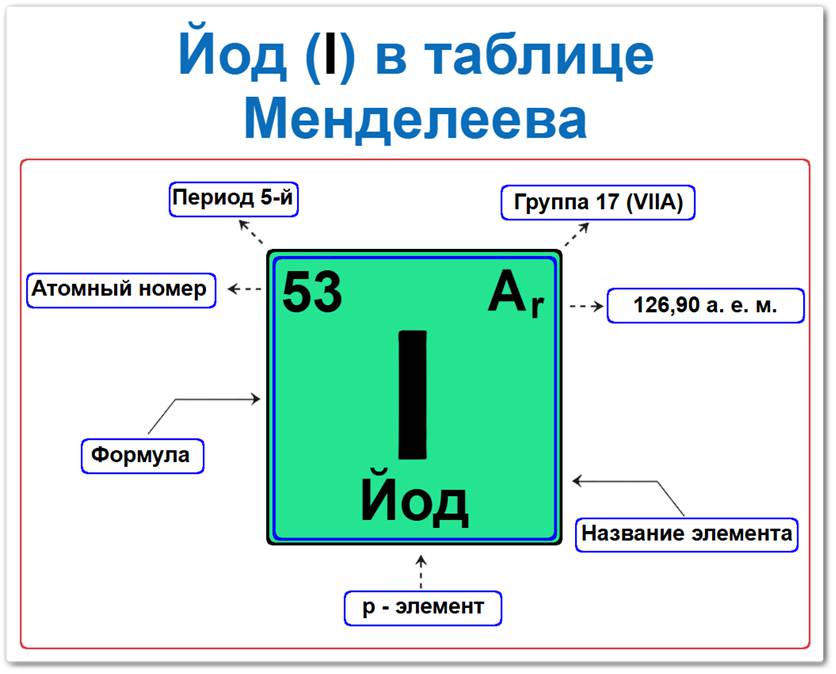
Йод (I) в периодической системе: 5‑й период, 17‑я группа (по устаревшей классификации — VII A), атомная масса 126,904 а.е.м.
Занимает положение в 5‑м периоде, что определяет его принадлежность к семейству галогенов — активных неметаллов, играющих критическую роль в биологических процессах и медицине.
Будучи типичным неметаллом, он входит в состав группы p-элементов, расположенных в правой части таблицы перед инертными газами.
Нахождение Йода в 17‑й группе и наличие семи электронов на внешнем уровне обуславливают его ключевые параметры:
Наиболее характерную валентность I (а также III, V, VII в возбужденном состоянии).
А также способность к сублимации (возгонке) и высокую химическую активность при взаимодействии с металлами и водородом.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Kr] 4d10 5s2 5p5.
На которой наглядно можно определить его положение как p-блочного элемента, где происходит заполнение 5p-подуровня.
Йод в таблице Менделеева можно определить на основании закона периодичности: положение в группе галогенов, период 5, группа 17, а также по его уникальному порядковому номеру (Z = 53).
Как определить положение Йода в Таблице Менделеева
Локация йода в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (17-я группа, семейство галогенов).
- Период (горизонтальный ряд).
- Электронное семейство (йод — p‑элемент).
Порядковый номер / атомный номер (Z = 53)
- Служит уникальным кодом элемента в системе.
- В ядре — 53 протона; в нейтральной оболочке — 53 электрона.
- Электронное строение: [Kr] 4d10 5s2 5p5.
Важно: До завершения внешнего электронного слоя йоду не хватает всего одного электрона, что делает его сильным окислителем.
Название и символ
- Название: «йод» (от греч. «ioeides» — фиалковый, темно-синий).
- Символ: I.
- Примечание: Открыт Бернаром Куртуа в 1811 году, в природе встречается в виде йодидов в морской воде и водорослях.
Группа (17 / VII A)
Расположен в 17‑й группе (главная подгруппа VII группы). Это группа галогенов («солеродов»).
Химический потенциал:
- Валентность йода: основная валентность I, в соединениях с кислородом может проявлять валентности III, V, VII.
- Степень окисления: от -1 до +7.
Период (5‑й)
Находится в 5‑м периоде — его электроны распределены по пяти энергетическим уровням.
Влияние на свойства:
- Физическое состояние: При нормальных условиях это твердое вещество черно-серого цвета с металлическим блеском.
- Биологическая роль: Необходим для синтеза гормонов щитовидной железы.
Относительная атомная масса (Ar)
- Ar(I) ≈ 126,904 а.е.м.
- Определение: среднее значение массы природных изотопов, представленных единственным стабильным изотопом Йод-127.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
p‑Элемент (электронное семейство)
Застраивающимся является 5p‑подуровень (5p5).
Специфика блока: Как p-элемент, йод проявляет типичные свойства неметаллов, уступая по активности вышестоящим фтору, хлору и брому.
Все значения для всех элементов можно узнать в таблице атомных масс.
Определение энергетических уровней Йода по Таблице Менделеева
Положение Йода (I) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 5-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Йода 5 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Йода — 53. Его 53 электрона распределены по уровням следующим образом:
I ) 2 ) 8 ) 18 ) 18 ) 7
3. 17-я группа (Химический характер)
- p-элемент: Активный неметалл.
- Место в блоке: Находится в нижней части группы галогенов, что делает его менее агрессивным по сравнению с хлором.
Проверка знаний: Как определить йод по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Йод (I) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 53. Код элемента в системе.
- 2) 5-й период, галоген. Его точное семейство и ряд.
- 3) p-элемент. Классификация по заполняемой орбитали.
Часто задаваемые вопросы:
Йод расположен в 5-м периоде. Относится к 17-й группе (главная подгруппа VII группы). Его атомный номер — 53.
У атома йода 5 энергетических уровней.
Электронная схема распределения: 2, 8, 18, 18, 7.
Йод является p-элементом. Его внешние электроны заполняют p-подуровень пятого слоя.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.