Амид это органическое сложное вещество, в состав которого входят углерод C, водород H, кислород O и обязательно азот N.
Считается, что они представляют производные кислот, состоящие из азота, карбоксильной группы и алкильных групп.

Что такое амид
Амид это азотсодержащее соединение, которое относится к одному из двух классов: аммиак и амины.
Когда гидроксильную группу (OH) кислоты заменяют аминогруппой, в результате получается нейтральное или очень слабокислотное соединение (NR2, в котором R может быть представлен либо в виде атома водорода, либо в виде органической объединяющей группы, такой как метил, CH3).
Наиболее важной группой являются карбоксамиды (R’CONR2), которые являются производными карбоновых кислот (R’COOH).
Сульфаниламиды (RSO2NR2) по структуре родственны сульфоновым кислотам (RSO3H).
Ионные амиды, также известные как солеподобные амиды, представляют собой чрезвычайно щелочные соединения, образующиеся в результате взаимодействия аммиака, амина или ковалентного амида с реакционноспособным металлом, таким как натрий.
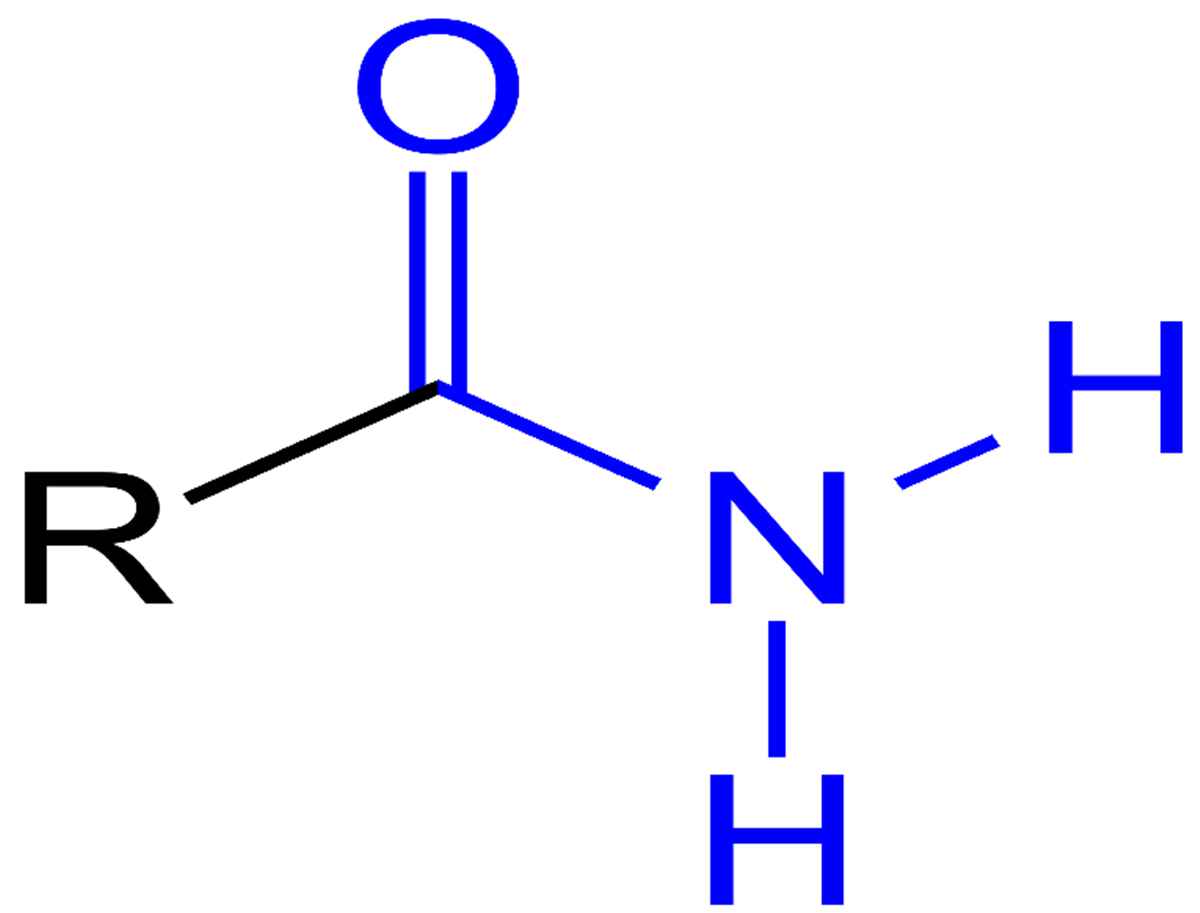
Формула амида или формула амидной группы — CO-NH.
Ковалентные амиды
За исключением формамида, который представляет собой жидкость, ковалентные амиды, полученные из аммиака, являются твердыми веществами; те, которые содержат менее пяти атомов углерода, растворимы в воде.
Они не являются электропроводниками и являются как органическими, так и неорганическими растворителями
Даже ковалентные амиды с низкой молекулярной массой имеют высокие температуры кипения.
Хотя полиамиды (амиды, соединенные вместе для создания огромных молекул, называемых полимерами) широко распространены в качестве белка живых систем, практически не существует природных источников простых ковалентных амидов.
Простые амиды обычно образуются при взаимодействии кислот или галогенидов кислот с аммиаком или аминами. Они также могут образовываться при реакции воды с нитрилами.
Гидролиз (химическая реакция с водой) — это реакция, посредством которой ковалентные амиды превращаются в кислоты и амины; эта реакция обычно протекает медленно, если ее не катализирует сильная кислота, щелочь или фермент.
Амиды также могут быть обезвожены с получением нитрилов. Амиды трудно окислять или восстанавливать, однако гидрирование (добавление водорода при высоких температурах и давлениях) преобразует большинство амидов карбоновых кислот в амины в присутствии катализатора.
Алюмогидрид лития, мощный восстановитель, превращает амиды в амины.
Имиды — это соединения, имеющие две карбонильные (СО) группы, связанные с одним и тем же атомом азота, образующиеся при взаимодействии амидов с хлоридами или ангидридами кислот.
Ацетамид, также известный как этанамид (CH3CONH2) и диметилформамид HCON(CH3)2, которые используются в качестве растворителей, сульфаниламидных препаратов и нейлона, являются одними из коммерчески важных амидов.
Мочевина, также известная как карбамид [CO(NH2)2], представляет собой кристаллическое соединение, образующееся как побочный продукт синтеза белка и выводимое с мочой млекопитающих.
Его производят из аммиака и двуокиси углерода в больших количествах для использования в удобрениях, кормах для животных и при производстве карбамидоформальдегидных смол, которые используются для изготовления пластмасс.
Химические свойства амидов
Химические свойства амидов приведены ниже:
1. Амидная группа проявляет резонанс из-за присутствия одинокой пары в азоте.
2. Из-за частичной двойной связи амиды проявляют ограничение по размерам.
3. Амиды амфотерны по своей природе, действуя как кислота, так и основание.
4. При наличии высокоэлектроотрицательного элемента (кислорода) в амидной группе амиды участвуют в образовании водородных связей.
5. Амиды подвергаются нескольким химическим реакциям. Эти химические реакции включают реакцию перегруппировки Гофмана, реакцию восстановления амида, реакцию Вильсмайера-Хаака.
6. Реакция гидролиза. При нагревании амидов с водой, кислотами или щелочами происходит реакция гидролиза с образованием карбоновых кислот и свободного аммиака в виде продукта.
7. Дегидратация- амиды дают реакцию дегидратации при нагревании с дегидратирующим агентом, таким как пятиокись фосфора (P2O5), треххлористый фосфор PCl3 и сульфонилдихлорид SOCl2, амиды теряют молекулу воды с образованием нитрилов (цианидов).
Номенклатура амидов
Термин «амид» добавляется к основному названию исходной кислоты в стандартной номенклатуре.
Ацетамид, например, представляет собой амид, полученный из уксусной кислоты (CH3CONH2).
Хотя ИЮПАК рекомендует этанамид, это и другие официальные названия используются редко.
Азотистые заместители встречаются первыми в названии амида, получаемого из первичного или вторичного амина.
Формула амида или формула амида кислоты представляет собой CO-NH.
N,N-диметилацетамид (CH3CONMe2, где Me = CH3) представляет собой амид, образующийся из диметиламина и уксусной кислоты.
Даже название обычно сокращают до диметилацетамида. Лактамы представляют собой циклические амиды, которые имеют либо вторичную, либо третичную природу.
Получение амида
Амиды это соединения с атомами азота, присоединенными к атому углерода карбонильной группы.
К амидам, так же как и к аминам, применяются различные требования к номенклатуре, но все они включают суффикс, специфичный для класса, – amide.
В процессе амидирования карбоновые кислоты вступают в реакцию с аминами или аммиаком с образованием амидов.
Амид образуется из остаточных частиц карбоновой кислоты и амина, когда молекула воды удаляется из реакции.
Получение амидов из аминов и карбоновых кислот является биологически значимым процессом.
Аминокислоты (молекулы как с аминными, так и с карбоновыми кислотными заместителями) соединяются вместе в полимер, образуя таким образом белки.
Типы амидов
При посещении амида есть несколько вещей, которые вы должны знать о номенклатуре, будь то название или структура.
Первичный амин, вторичный амин и третичный амин — это три типа аминов, основанные на их названиях.
Различия классифицируются в соответствии с положением атома азота по отношению к атому углерода в цепи молекулы.
При определении первичного амида используйте «ic acid» или «oic acid» в конце, за которым следует «амид».
Чтобы показать, что азот связан с алкильной группой, вторичный амид назван путем объединения N.
Углеводородная цепь с атомами водорода и углерода известна как алкильная группа.
Функциональная группа амида
Функциональные группы амида приводят к идентификации определенной группы атомов в более крупной молекуле.
Примерами функциональных групп являются алканы и спирты, включая нашего особого друга, амид.
Амид это функциональная группа с карбонильной группой и атомом азота, которая может быть образована из различных функциональных групп карбоновой кислоты.
Структура амида
Чтобы запомнить структуру амида, все, что вам нужно помнить, это то, что амидное соединение должно иметь атом азота.
1. Карбонильная группа состоит из двух атомов углерода, которые дважды связаны с атомом кислорода.
2. Аминогруппа, в которой атом азота имеет единственную связь с R-группами, является второй.
R-группы можно рассматривать как заместители для других атомов или молекул в структуре.
3. Существует единственная связь, которая также является определяющей функциональной группой амида.
Структура трех различных типов амидов показана на диаграмме выше. Для трех разных амидов атом азота находится в разном положении.
В случае первичного амида атом азота связан с одним атомом углерода. В случае вторичного амина атом азота связан с двумя атомами углерода.
Азот в третичном амиде связан с тремя атомами углерода.
Амиды как основания
Амиды являются очень слабыми основаниями по сравнению с аминами. Сопряженная кислота амина имеет pKa примерно 9,5, тогда как сопряженная кислота амида имеет pKa около 0,5.
В результате амиды не обладают столь четкими кислотно–основными характеристиками в воде.
Карбонил забирает электроны у амина, что объясняет относительное отсутствие основности.
Амиды, с другой стороны, являются гораздо более мощными основаниями, чем карбоновые кислоты, сложные эфиры, альдегиды и кетоны (PKA их сопряженных кислот колеблется от 6 до 10).
Ключевые моменты амида
1. Атом азота связан с карбонильным атомом углерода в типичной структуре амидов.
2. Формула амида кислоты или формула амидной группы — CO-NH.
3. ic кислота общего названия или -oic окончание IUPAC для соответствующей карбоновой кислоты заменяется на -амид в названиях амидов.
Быстрые ответы?
Амиды представляют собой производные кислот, состоящие из азота, карбоксильной группы и алкильных групп.
Амиды широко используются в технологии в качестве конструкционных материалов. Амидная смесь проста в разработке, устойчива к гидролизу и обеспечивает жесткость конструкции.
Наиболее эластичными материалами являются полиамиды и нейлон. Различные лекарства, такие как пенициллин, ЛСД и парацетамол, являются амидами.
Кроме того, N-алкиламиды растений обладают широким спектром биологических функций.
Карбоксамиды, сульфаниламиды и фосфорамидиты являются примерами амидов. Полиамиды, такие как нейлон, представляют собой тип полимера.