Теория:
Молекула углекислого газа (диоксид углерода) — это химическое соединение с формулой CO2.
Состоит из одного атома углерода (C) и двух атомов кислорода (O).
Эти атомы расположены по прямой линии (O = C = O), что делает молекулу симметричной.
Углекислый газ — это бесцветный газ без запаха, который тяжелее воздуха.
Он играет ключевую роль в дыхании (мы его выдыхаем), фотосинтезе (растения его поглощают) и парниковом эффекте (он удерживает тепло в атмосфере Земли).
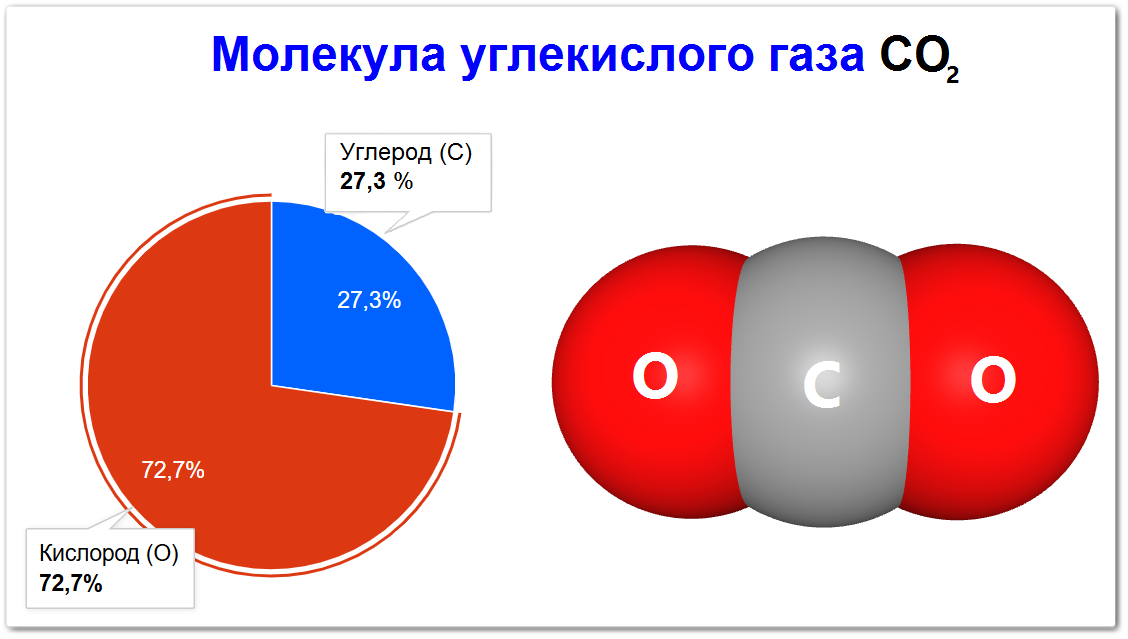
Молекула углекислого газа, или диоксида углерода, с химической формулой CO2, является одним из самых важных и распространенных соединений на Земле.
Она играет ключевую роль как в биологических процессах, так и в климатической системе планеты.
Состав и формула
Химическая формула: CO2
Состав: Одна молекула CO2 состоит из одного атома углерода (C) и двух атомов кислорода (O).
Строение и геометрия
Тип связи: Атомы углерода и кислорода соединены между собой двойными ковалентными связями.
Это означает, что каждый атом углерода образует по две общие электронные пары с каждым из двух атомов кислорода (O=C=O).
Геометрия молекулы: Молекула CO2 имеет линейную форму. Атом углерода расположен точно по центру, а два атома кислорода находятся на одной прямой с ним, симметрично друг другу. Угол между связями O=C=O составляет 180°.
Полярность: Несмотря на то, что каждая связь C=O сама по себе является полярной (кислород более электроотрицателен и «тянет» электроны к себе), молекула CO2 в целом неполярна.
Это объясняется её симметричной линейной структурой: дипольные моменты двух связей C = O направлены в противоположные стороны и полностью компенсируют друг друга.
Молекулярная и молярная масса
Относительные атомные массы (приблизительно):
Углерод (C): 12.011 а.е.м.
Кислород (O): 15.999 а.е.м.
Молекулярная масса CO2: 12.011 + (2 × 15.999) = 12.011 + 31.998 = 44.009 а.е.м.
Молярная масса CO2: ~44.01 г/моль (масса одного моля вещества).
Физические свойства (при стандартных условиях)
Агрегатное состояние: Газ.
Цвет: Бесцветный.
Запах: Практически без запаха. В очень высоких концентрациях может ощущаться слабый кисловатый запах, напоминающий газированные напитки.
Плотность: Углекислый газ значительно тяжелее воздуха (молярная масса воздуха ~29 г/моль против 44 г/моль у CO2).
Его плотность при нормальных условиях около 1.98 кг/м3.
Растворимость в воде: Умеренно растворим в воде, образуя очень слабую и нестабильную угольную кислоту (H2CO3), которая быстро распадается.
Именно благодаря этой растворимости газируются напитки.
Фазовые переходы: Углекислый газ не переходит в жидкое состояние при нормальном атмосферном давлении.
При охлаждении до -78.5 °C он сразу переходит из газообразного состояния в твердое, минуя жидкое. Твердый CO2 называется «сухой лед».
Химические свойства
- Кислотный оксид: CO2 является кислотным оксидом. Он реагирует с водой (образуя угольную кислоту) и со щелочами (образуя карбонаты и гидрокарбонаты).
- Не поддерживает горение: Углекислый газ сам не горит и не поддерживает горение большинства веществ, поэтому используется в огнетушителях.
- Окислитель: Атом углерода в CO2 находится в высшей степени окисления (+4), что придает ему окислительные свойства в определенных реакциях (например, с активными металлами).
Роль и применение
Биологическая роль:
- Фотосинтез: Крайне необходим для растений, водорослей и некоторых бактерий, которые используют CO2 из атмосферы для производства органических веществ (пищи) и кислорода.
- Дыхание: Является конечным продуктом клеточного дыхания у животных, растений и человека и выводится из организма.
- Климатическая роль: CO2 является одним из важнейших парниковых газов. Он поглощает и излучает инфракрасное излучение, тем самым удерживая тепло в атмосфере Земли и способствуя парниковому эффекту, который поддерживает температуру планеты пригодной для жизни. Однако увеличение его концентрации из-за деятельности человека приводит к глобальному потеплению.
Промышленное применение:
- Пищевая промышленность: Для газирования напитков, сохранения продуктов (сухой лед), в качестве охладителя.
- Пожаротушение: В огнетушителях.
- Сварка: В качестве защитного газа.
- Медицина: В некоторых медицинских процедурах.
- Сельское хозяйство: Для стимуляции роста растений в теплицах.
Молекула CO2 — это простой, но фундаментальный компонент нашей планеты, постоянно участвующий в различных циклах и процессах.
Пример решения:
Задача № 1.
Дано: Какова масса 0.75 моль углекислого газа (CO2)?
Решение: Масса (m) = Количество вещества (n) × Молярная масса (M)
m(CO2) = 0.75 моль × 44.01 г/моль = 33.0075 г.
Ответ: 33.0075 г.
Задача № 2.
Дано: Сколько моль углекислого газа (CO2) содержится в 88.02 граммах этого газа?
Решение: Количество вещества (n) = Масса (m) / Молярная масса (M)
n(CO2) = 88.02 г/44.01 г/моль = 2 моль.
Ответ: 2 моль.
Задача № 3
Сколько молекул содержится в углекислом газе массой 1 грамм.
Чтобы узнать, сколько молекул содержится в 1 грамме углекислого газа (CO2), нам понадобятся две константы и молярная масса CO2:
Молярная масса CO2 (M):
Атомная масса углерода (C) ≈ 12.011 г/моль.
Атомная масса кислорода (O) ≈ 15.999 г/моль.
M(CO2) = 12.011 + (2 × 15.999) = 12.011 + 31.998 = 44.009 г/моль
Число Авогадро (Nа):
Nа ≈ 6.022×1023
молекул/моль (это количество молекул в одном моле любого вещества).
Теперь мы можем провести расчет в два этапа:
Этап 1: Рассчитаем количество моль CO2 в 1 грамме.
Количество моль (n) = Масса (m) / Молярная масса (M)
n(CO2) = 1 г / 44.009 г/моль. ≈ 0.022722 моль
Этап 2: Рассчитаем количество молекул.
Количество молекул = Количество моль (n) × Число Авогадро (NA)
Количество молекул = 0.022722 моль × (6.022 × 1023молекул/моль)
Количество молекул ≈1.368 × 1022 молекул.
Ответ: в 1 грамме углекислого газа содержится приблизительно 1.368 × 1022
молекул.
Часто задаваемые вопросы:
СО2, углерод С и кислород О.
Между атомом углерода и каждым из двух атомов кислорода образуется ковалентная связь.
Более точно, это двойная ковалентная связь.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.