Теория:
Молекулярная масса карбоната кальция (СaCO3) это масса одной молекулы вещества, выраженная в атомных единицах массы (а.е.м.).
Поэтому она рассчитывается как сумма атомных масс входящих в ее состав элементов.
Молекулярную массу каждого химического элемента можно найти в таблице химических элементов Менделеева.
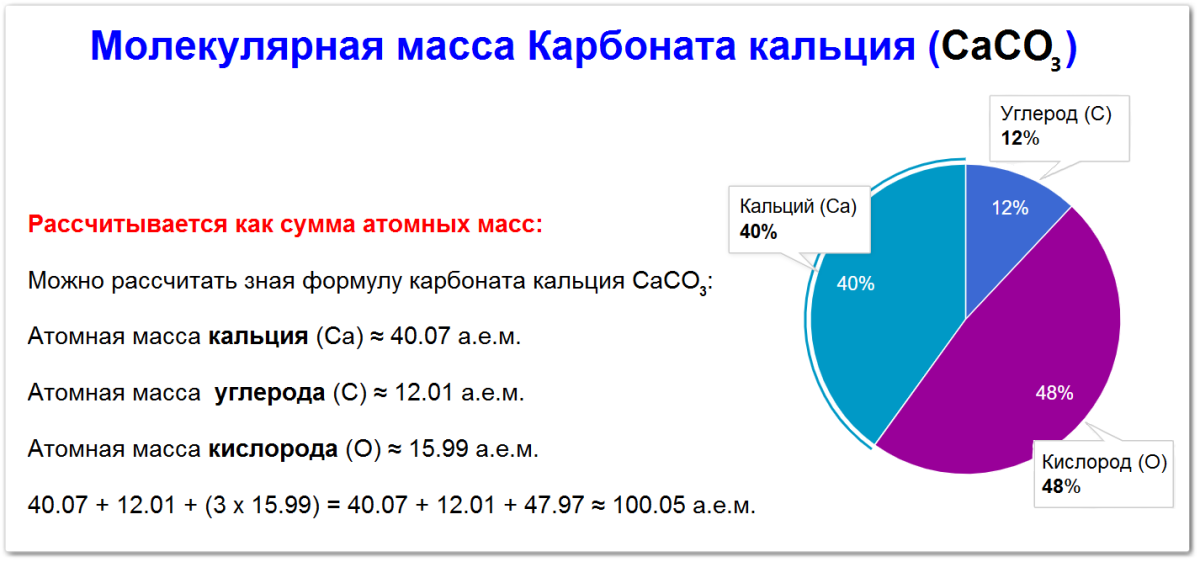
Как вычислить молекулярную массу карбоната кальция (СaCO3)
Молекулярная масса карбоната кальция рассчитывается как сумма атомных масс входящих в его состав элементов:
Атомная масса кальция (Са) ≈ 40.07 а.е.м.
Атомная масса углерода (С) ≈ 12.01 а.е.м.
Атомная масса кислорода (О) ≈ 15.99 а.е.м.
Поэтому молекулярная масса составляет:
Mr(СаСО3) = Ar(Са) + Ar(С) + (3 х Ar(О)) = 40.07 + 12.01 + (3 х 15.99) = 40.07 + 12.01 + 47.97 ≈ 100.05 а.е.м.
Молярная масса карбоната кальция которая численно равна молекулярной массе, составляет примерно 100.05 г/моль.
Часто используют округленные значения атомных масс (Са = 40.07, С = 12.01, О = 47.97), в этом случае молекулярная масса будет: 100 г/моль.
Процентное содержание элементов в карбонате кальция (СаСО3)
Процентное содержание элементов в углекислом газе (СаСО3) рассчитывается на основе его молекулярной массы.
Молекулярная масса ≈ 100.05 а.е.м (если использовать более точные атомные массы: Са = 40.07, С ≈ 12.01, О ≈ 47.97 а.е.м.).
Если использовать округленные значения (Са = 40, С = 12, О = 50 а.е.м.), то молекулярная масса будет ≈ 100 а.е.м.
Рассчитаем процентное содержание, используя округленные значения для простоты:
1. Масса кальция (Са):
- В молекуле СаСО3 содержится 1 атом кальция.
- Общая масса кальция = 40 а.е.м.
2. Масса углерода (С):
- В молекуле СаСО3 содержится 1 атом углерода.
- Общая масса углерода = 12 а.е.м.
3. Масса кислорода (О):
- В молекуле СаСО3 содержится 3 атома кислорода.
- Масса кислорода = 16 х 3 = 48 а.е.м.
3. Общая молекулярная масса (СаСО3):
40 а.е.м. + 12 а.е.м. + 48 а.е.м. = 100 а.е.м.
4. Процентное содержание кальция:
- (Масса кальция / Молекулярная масса СаСО3) × 100% = (40 / 100) × 100% ≈ 40 %
5. Процентное содержание углерода:
- (Масса углерода / Молекулярная масса СаСО3) × 100% = (12 / 100) × 100% ≈ 12 %
6. Процентное содержание кислорода:
- (Масса кислорода / Молекулярная масса СаСО3) × 100% = (48 / 100) × 100% ≈ 48 %
Таким образом, в карбонате кальция содержится примерно:
- 40 % кальция
- 12 % углерода
- 48 % кислорода
Если использовать более точные атомные массы, процентные содержания будут немного отличаться.
Пример решения, задача:
Дано: Карбонат кальция (CaCO3) разлагается при нагревании с образованием оксида кальция (CaO) и углекислого газа (CO2):
CaCO3 → CaO + CO₂
Какая масса оксида кальция (CaO) образуется при разложении 200 г карбоната кальция? (Используйте округленные молярные массы: CaCO3 = 100 г/моль, CaO = 56 г/моль).
Решение:
1. Найдем количество вещества:
CaCO3: n(CaCO₃) = 200 г / 100 г/моль = 2 моль
2. Согласно уравнению реакции, количество вещества CaO равно количеству вещества CaCO3: n(CaO) = 2 моль
3. Найдем массу:
CaO: m(CaO) = n(CaO) × M(CaO) = 2 моль × 56 г/моль = 112 г
Ответ: 112 г.
Часто задаваемые вопросы
Молярная масса карбоната кальция (CaCO3) составляет 100.09 г/моль.
Молярная масса выражается в граммах на моль (г/моль) и представляет собой массу одного моля вещества.
Один моль содержит число Авогадро (примерно 6.022 × 1023) молекул или структурных единиц.
Таким образом, масса одного моля карбоната кальция, что содержит 6.022 × 1023 молекул CaCO3, составляет 100.09 грамм.
Рассчитывается как сумма атомных масс:
(Са) ≈ 40.07 а.е.м. + (С) 12.01 а.е.м. + (3 х (О) 15.99 а.е.м. ≈ 100.05 а.е.м.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.